
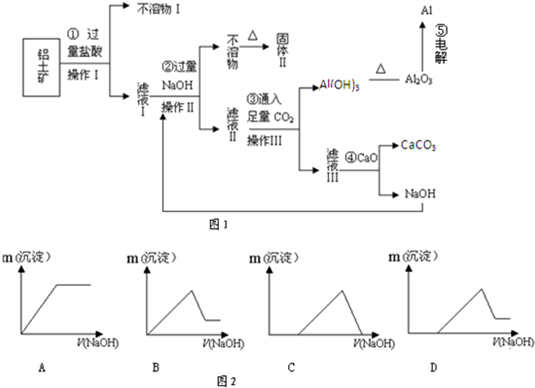
(16分)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
(1)沉淀A、B的成分分别是 、 ;
(2)步骤②中的试剂a是 ;
(3)试写出步骤③中发生反应的离子方式 ;
(4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要错误是:
① ;
② 。
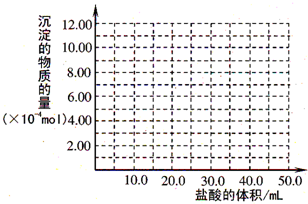
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为 ,样品中Al2O3的百分含量为 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
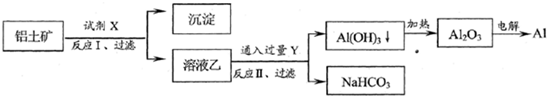
| A、试剂X为稀硫酸 | B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O→Al(OH)3↓+HCO3- | C、结合质子(H+)的能力由强到弱的顺序是:OH->AlO2->CO32- | D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
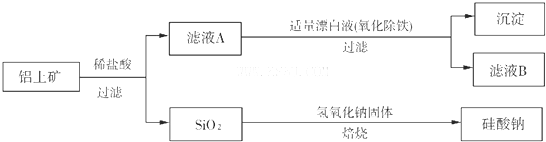
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com