
 某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:
某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了如图装置制取Cl2,并进行实验探究.回答下列问题:| 5 |
| 8 |


科目:高中化学 来源: 题型:
 如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )
如图为1mol甲烷在足量的氧气中燃烧生成CO2(g)和H2O(g)时的能量变化示意图,由此图分析得出的下列结论中正确的是( )| A、甲烷燃烧为吸热反应 |
| B、甲烷的燃烧热△H=-802kJ?mol-1 |
| C、EA-EB=1015kJ |
| D、该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

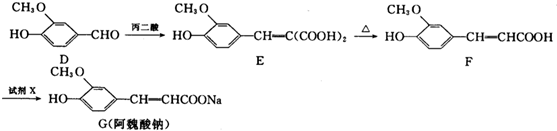
| 丙二酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com