
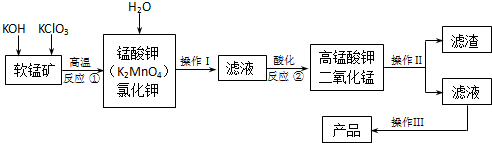
| 2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
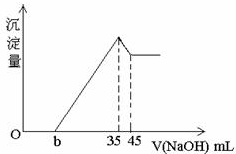 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mlH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.则原H2SO4物质的量溶度是( )| A、A、1mol/L |
| B、B、1.75mol/L |
| C、C、3.5mol/L |
| D、D、2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氨水 |
| D、澄清石灰水中通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯水在25℃和80℃时的pH值 |
| B、25℃时,pH=3的盐酸和AlCl3溶液中,水电离的氢离子的浓度 |
| C、耐火材料CaO和MgO的熔点 |
| D、1L pH=2的盐酸和醋酸溶液中,分别投入足量锌粒,放出H2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 |
| B、将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 |
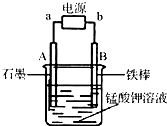
C、 如图,一段时间后给烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成 |
| D、向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | KCl溶液 | I2 | 酒精,萃取 |
| B | KNO3 | K2SO4 | Ba(NO3)2溶液,过滤 |
| C | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发结晶 |
| D | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的转化率变小 |
| B、平衡向正反应方向移动 |
| C、D的物质的量变大 |
| D、a>c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com