
| A、强酸性溶液中:I-、Cl-、NO-3、Fe2+ |
| B、含大量Al3+的溶液中:Na+、AlO-2、NO-3、HCO-3 |
| C、含大量Fe2+的溶液中:K+、Na+、SO2-4、Cl2 |
| D、室温下,pH=13的溶液:CO2-3、Cl-、F-、K+ |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应:Fe+2H+=Fe3++H2↑ |
| B、钠与冷水反应:Na+2H2O=Na++2OH-+H2↑ |
| C、醋酸与大理石反应:2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O |
D、二氧化碳与苯酚钠溶液反应: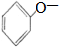 +H2O+CO2→ +H2O+CO2→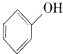 +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L O3含有分子的数目为NA |
| B、常温常压下,4.0gCH4中含有共价键的数目为NA |
| C、电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 |
| D、标准状况下,2.24LC12与过量NaOH溶液反应,转移电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)<c(Na+) |
| B、c(CH3COOH)+c(CH3COO-)=0.02mol/L |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(OH-)+c(CH3COO-)═c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
| B、Na与H2O反应制备H2:2Na+2H2O═2Na++2OH-+H2↑ |
| C、将氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| D、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石跟稀盐酸反应:CO32-+2H+=CO2↑+H2 O |
| B、铁与硫酸铁溶液反应:Fe+Fe3+=2Fe2+ |
| C、A1C13溶液中加入足量的氨水:Al++3OH-=Al(OH)3↓ |
| D、铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
2- 7 |
| Fe+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com