
【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
(1) 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率等于____________。
(2) 实验②中,该反应的平衡常数K=____________。
(3) 实验③中,达到平衡时,X的转化率为____________。
(4) 实验④中,达到平衡时,b____________0.060 (填大于、小于、等于)
(5) 实验③中,达到平衡时,a等于 ____________。
【答案】(1)0.001mol/(l.min) (2)1 (3)0.6 或60% (4),< (5) 0.12
【解析】
试题分析:(1)实验①中,若5min时测得n(M)=0.050mol,浓度是0.0050mol/L,则根据反应的化学方程式可知,同时生成的N的物质的量也是0.0050mol/L ,因此0至5min时间内,用N表示的平均反应速率υ(N)=0.0050mol/L ÷5min=1.0×10-3mol/(L·min);
(2)实验②中,平衡时M的浓度是0.0080mol/L,则同时生成的N的浓度是0.0080mol/L,消耗X与Y的浓度均是0.0080mol/L,因此平衡时X和Y的浓度分别为0.01mol/L-0.0080mol/L=0.002mol/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数K=![]() =1;
=1;
(3)根据反应的化学方程式可知,设X的转化率为x,则
X(g) + Y(g)![]() M(g) + N(g)
M(g) + N(g)
起始浓度(mol/L) 0.020 0.030 0 0
转化浓度(mol/L) 0.02x 0.02x 0.02x 0.02x
平衡浓度(mol/L)0.02-0.02x 0.03-0.02x 0.02x 0.02x
温度不变,平衡常数不变,则K=![]() =1,解得x=0.6,即平衡时X的转化率为60%。
=1,解得x=0.6,即平衡时X的转化率为60%。
(4)根据(3)中可知a=0.2×0.6=0.12。700℃时
X(g) + Y(g)![]() M(g) + N(g)
M(g) + N(g)
起始浓度(mol/L) 0.040 0.010 0 0
转化浓度(mol/L) 0.009 0.009 0.009 0.009
平衡浓度(mol/L)0.031 0.001 0.009 0.009
则该温度下平衡常数K=![]() =2.9>1,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。若容器④中温度也是800℃,由于反应前后体积不变,则与③相比④平衡是等效的,因此最终平衡时M的物质的量b=0.5a=0.06。当温度升高到900℃时平衡显逆反应方向移动,因此b<0.060。
=2.9>1,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。若容器④中温度也是800℃,由于反应前后体积不变,则与③相比④平衡是等效的,因此最终平衡时M的物质的量b=0.5a=0.06。当温度升高到900℃时平衡显逆反应方向移动,因此b<0.060。
(5)根据以上分析可知a=0.12。
【考点地位】本题主要是考查化学反应速率和化学平衡常数的有关判断与计算
【名师点晴】本题难度大,综合性强。该类试题重点考查了学生对基本概念的理解和综合分析应用能力,对转化率的计算与等效平衡和化学平衡移动结合起来分析,考查了基本概念的内涵和外延,对学生的要求较高。该题的难点在于平衡常数和等效平衡的应用。所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。等效平衡一般有三种类型:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△n=0的体系):等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。解答该类型试题的关键是分清类别,用相应的方法求解即可。


科目:高中化学 来源: 题型:
【题目】实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
【方案一】:沉淀法.利用化学反应把HCO3﹣、CO32﹣完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3).
(1)量取100mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3﹣、CO32﹣完全转化为沉淀,应选用的试剂是 (填编号).
A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液
(2)将所得沉淀充分干燥,称量沉淀的质量为mg,由此可以计算ω(Na2CO3).如果此步中,沉淀未干燥充分就称量,则测得ω(Na2CO3) (填“偏大”、“偏小“或“无影响”).
【方案二】:量气法.量取10.00mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105Pa)的体积,由此计算混合物中ω(Na2CO3)。
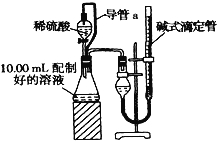
(1)装置中导管a的定量作用是 .
(2)若撤去导管a,使测得气体体积 (“偏大”,“偏小”或“无影响”).
【方案三】:滴定法.量取25.00mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000molL﹣1的盐酸滴定到终点(已知终点时反应H++CO32﹣═HCO3﹣恰好完全).重复此操作2次,消耗盐酸的体积平均值为20.00mL.
(1)量取25.00mL配制好的溶液,应选择 仪器来完成.
(2)判断滴定终点的依据是 .
(3)此法测得ω(Na2CO3)= %.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①电子云中的一个小黑点代表一个电子 ② 电子云密度大的地方,说明电子在核外空间单位时间内出 现的机会多 ③ 原子轨道是指原子运行的轨道 ④s 电子的电子云呈球形,p 电子的电子云呈哑铃形
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中前7周期的元素种类如下:
周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
请你从中寻找规律,并预言第8周期最多可能包含的元素种类为()
A. 18 B. 32 C. 50 D. 64
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,其电解质为固体氧化物电解质,则下列说法中不正确的是( )
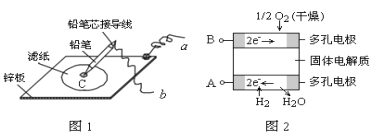
A. 图2电池放电过程屮,O2-从B极区向A极区迁移
B. 图2电池负极区的电极反应为H2-2e-+O2-=H2O
C. 若用氯化钠和酚酞混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关,下列说法错误的是()
A.采用催化抟化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毐气体
B.“雾霾天气” “温室效应” “光化学烟雾”的形成都与氮的氧化物无关
C.利用风能.太阳能等淸洁能源代替化石燃料,可减少环境污染
D.氮化硅陶瓷是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国油气资源匮乏而煤储量相对丰富。将煤转化为水煤气(CO、H2),不可能产生的效果是
A. 得到相对清洁的能源 B. 提高了能源利用率
C. 增加了单位质量煤的热值 D. 便于管道输送
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③40 19K和40 20Ca
④异戊烷(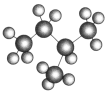 )
)
和新戊烷(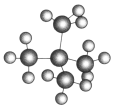 )
)
⑤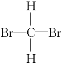 和
和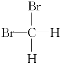 ⑥甲烷和丙烷
⑥甲烷和丙烷
(1)互为同位素的是________。
(2)互为同分异构体的是________。
(3)互为同系物的是________。
(4)为同一种物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则该溶液中( )
A.一定溶解有SO42- B.一定溶解有CO32-
C.一定溶有Ag+ D.可能是SO42-,也可能是Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com