
分析 B的最外层电子数为其内层电子数的3倍,最外层最多为8个电子,则B只能含有2个电子层,最外层为6个电子,则B为O元素;
D元素是地壳中含量最高的金属元素,所以D为Al元素;E原子核外的M层中有两对成对电子,电子排布式为1s22s22p63s23p4,所以E为S元素;
F原子核外最外层只有1个电子,其余各层电子均充满,且F是前四周期的元素,其核外电子数目为2+8+18+1=29,所以F为Cu元素;
A原子核外有三个未成对电子,且原子序数小于13,所以A为N元素,A与C可形成离子化合物C3A2,且C的原子序数大于A小于D,所以C是Mg元素,据此进行解答.
解答 解:B的最外层电子数为其内层电子数的3倍,最外层最多为8个电子,则B只能含有2个电子层,最外层为6个电子,则B为O元素;D元素是地壳中含量最高的金属元素,所以D为Al元素;E原子核外的M层中有两对成对电子,电子排布式为1s22s22p63s23p4,所以E为S元素;F原子核外最外层只有1个电子,其余各层电子均充满,且F是前四周期的元素,其核外电子数目为2+8+18+1=29,所以F为Cu元素;A原子核外有三个未成对电子,且原子序数小于13,所以A为N元素,A与C可形成离子化合物C3A2,且C的原子序数大于A小于D,所以C是Mg元素,
(1)F为Cu元素,其 原子序数=核外电子总数=29,则Cu的原子核外电子排布式为:1s22s22p63s23p63d104s1;
A、B、C、D、E分别为:N、O、Mg、Al、S元素,Mg、Al、S元素是同一周期元素,同一周期元素的第一电离能逐渐增大,但镁的2s能级为全满稳定状态,其第一电离能大于铝的第一电离能;金属的第一电离能大于非金属元素,所以5种元素中第一电离能最小的为Al,
故答案为:1s22s22p63s23p63d104s1;Al;
(2)氧化镁是离子晶体,SO2和SO3为分子晶体,离子晶体的熔点远大于分子晶体的熔点,
故答案为:MgO为离子晶体而SO2和SO3为分子晶体;
(3)B为O、E为S,二者氢化物分别为水和硫化氢,由于水分子间存在氢键作用力大于硫化氢分子间的范德华力,所以水的沸点大于硫化氢,
故答案为:H2O大于H2S;
(4)NO3-中价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,所以N原子采取sp2杂化,D的低价氧化物是SO2,SO2的价层电子对=2+$\frac{1}{2}$(6-2×2)=3、含有一个孤电子对,所以分子空间构型是V型,
故答案为:sp2;V形;
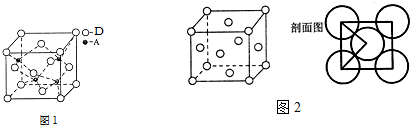
(5)Al原子位于面心、顶点,N原子位于晶胞体内,该晶胞中Al原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,N原子数目=4,所以其化学式为:AlN,
故答案为:AlN;
(6)Cu晶胞中Cu原子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量=$\frac{64×4}{{N}_{A}}$g,铜原子的半径是rcm,则棱长=4rcm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$r cm,则晶胞体积=(2$\sqrt{2}$r cm)3,故晶体的密度为:$\frac{\frac{64×4}{{N}_{A}}g}{(2\sqrt{2}{r)}^{3}}$=$\frac{256}{({2r\sqrt{2})}^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{256}{({2r\sqrt{2})}^{3}{N}_{A}}$.
点评 本题以元素的推断为载体,考查了核外电子排布、分子空间构型、原子的杂化、晶胞计算等,注意第ⅡA和第ⅢA族、第ⅤA族和第ⅥA族之间第一电离能异常,注意根据均摊法进行晶胞计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 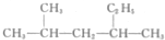 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 | |
| B. |  互为同分异构体 互为同分异构体 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2~3之间 | B. | 3~4之间 | C. | 4~5之间 | D. | 5~6之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 现象或结论 |
| A | 向2SO2+O2?2SO3的平衡体系中加入由18O构成的氧气 | 则SO2中的18O的含量会增加 |
| B | 向pH=1的盐酸和醋酸各0.5L的溶液中各加入1.4g铁粉 | 醋酸中生成H2的速率快且最终气体量多 |
| C | 以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉) | 阴极逸出气体且附近溶液渐呈红色 |
| D | 以Pb为负极,硫酸溶液为电解质的铅蓄电池,在放电过程中 | 负极质量增加,SO42-向负极迁移,溶液pH增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的二卤代物是4种,则其六卤代物是2种 | |
| B. | 对二甲苯的核磁共振氢谱显示有3种化学环境的氢 | |
| C. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 | |
| D. | 某烃的同分异构体只能形成一种一氯代物,其分子式可能为C5H12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
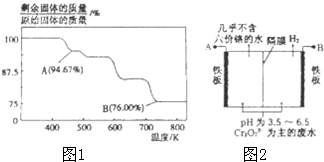 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2是该反应的催化剂 | B. | MFe2Ox是还原剂 | ||
| C. | X<Y | D. | SO2发生了置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com