
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
【答案】B
【解析】
在相同温度下,Ag2SO4的溶度积为定值,随着浓度SO42-的增大,Ag+浓度逐渐减小,位于曲线的点b、c为平衡状态,即溶液达到饱和,a为不饱和状态,以此解答该题。
A.在相同温度下,Kap相同,所以A选项是正确的;
B.蒸发溶液,Ag+浓度和SO42-浓度都增大,不可能为a点达到b点,故B错误;
C.由图象可以知道,Ag2SO4的溶度积常数Ksp=(0.02)2×0.04=1.6×10-5,所以C选项是正确的;
D.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(Ag+)=0.01moL/L,c(SO42-)=0.1mol/L,则(0.01)2×0.1=1×10-5<1.6×10-5,没有沉淀生成,所以D选项是正确的。
答案选B。


科目:高中化学 来源: 题型:
【题目】有机物K是某药物的前体,合成路线如图所示:
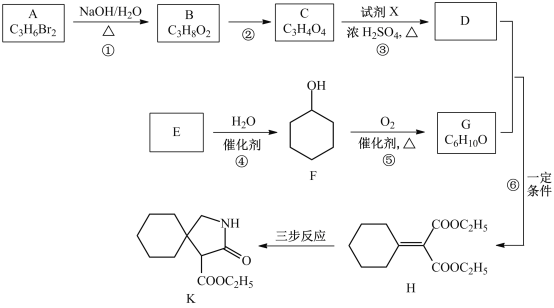
已知:R-CN![]()
![]() ;
;
![]()
![]() +
+![]()
(1)A的名称是_____________。
(2)反应①的化学方程式是___________________。
(3)反应②的类型是__________________。
(4)反应③中的试剂X是________________。
(5)E属于烃,其结构简式是_________________。
(6)H中所含的官能团是_________________。
(7)反应⑥的化学方程式是_____________________。
(8)H经三步反应合成K,写出中间产物I和J的结构简式______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)![]() H、
H、![]() H、
H、![]() H互为__;O2、O3互为__。
H互为__;O2、O3互为__。
(2)在下列固体中:a.CaCl2 b.KOH c.He d.H2SO4 e.NH4Cl f.金刚石
①其中不含化学键的物质是__。
②既含有离子键又含有共价键的物质是__(填序号)。
(3)如图是几种常见的电池装置。请回答:

①电池Ⅰ中负极反应式是__,溶液中H+向__(填“负”或“正”)极移动,若1mol电子流过导线,则产生氢气的物质的量是__mol。
②电池Ⅱ属于__电池(填“一次”或“二次”).
③电池Ⅲ是氢氧燃料电池,写出负极的电极反应式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行下列实验:
①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液
②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出现红褐色沉淀
③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀
④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
下列说法中不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. ①中浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是( )

A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗33.6 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为500℃时,反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v(x)为 ( )
4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v(x)为 ( )
A.v(O2)=0.01mol/(Ls)B.v(NO)=0.08mol/(Ls)
C.v(H2O)=0.0013mol/(Ls)D.v(NH3)=0.002mol/(Ls)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com