
| N |
| NA |
| n |
| V |
| 3.01×1023 |
| 6.02×1023mol-1 |
| 0.5mol |
| 0.5L |
| 2mol |
| 13 |
| 2 |
| 13 |
| 2 |
| 13 |
| 0.1mol×2 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
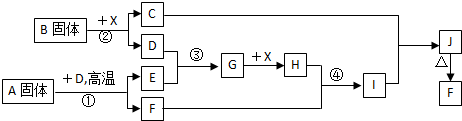
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L酒精含有的分子数约为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、1NA氧原子的质量(以g为单位)在数值上约等于其相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、Ca(OH)2、NH3?H2O |
| B、NH4Cl、CH3COOH、Na2S |
| C、HBr、HCl、BaSO4 |
| D、HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 g金刚石中含有的共价键数为2NA |
| B、22.4LNH3中含有的电子数为10NA |
| C、将1molCl2通入足量水中充分反应达到平衡后转移电子总数为NA |
| D、电解精炼铜时,当电路中转移2NA个电子时粗铜的质量减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、500 |
| B、600 |
| C、1 200 |
| D、1 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com