

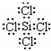
 ,D是氢氧化钠,氢氧化钠中含有离子键和共价键,故答案为:KSCN,
,D是氢氧化钠,氢氧化钠中含有离子键和共价键,故答案为:KSCN,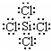 ,离子键和(极性)共价键;
,离子键和(极性)共价键; H2↑+Cl2↑+2OH-,四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,反应方程式为:Fe3O4+8 HCl═2FeCl3+FeCl2+4H2O,故答案为:2Cl-+2H2O
H2↑+Cl2↑+2OH-,四氧化三铁和盐酸反应生成氯化铁、氯化亚铁和水,反应方程式为:Fe3O4+8 HCl═2FeCl3+FeCl2+4H2O,故答案为:2Cl-+2H2O H2↑+Cl2↑+2OH-,Fe3O4+8 HCl═2FeCl3+FeCl2+4H2O;
H2↑+Cl2↑+2OH-,Fe3O4+8 HCl═2FeCl3+FeCl2+4H2O; Si+2CO↑,该反应中每消耗1mol X,转移电子=1mol(4-0)=4mol,
Si+2CO↑,该反应中每消耗1mol X,转移电子=1mol(4-0)=4mol, Si+2CO↑,4.
Si+2CO↑,4.

科目:高中化学 来源: 题型:
 (2011?咸阳模拟)A、D、E、G四种单质和X、Y、Z三种化合物均是中学化学中的重要物质,他们之间有如图所示的转化关系.常温常压下,X是无色无味的液体,Y是黑色晶体,Z的水溶液是一种弱酸,反应(1)不能在玻璃仪器中进行.请回答下列问题:
(2011?咸阳模拟)A、D、E、G四种单质和X、Y、Z三种化合物均是中学化学中的重要物质,他们之间有如图所示的转化关系.常温常压下,X是无色无味的液体,Y是黑色晶体,Z的水溶液是一种弱酸,反应(1)不能在玻璃仪器中进行.请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:



| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省高三第一周考试化学试卷(解析版) 题型:选择题
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是

A.N一定是HCl(aq) B.X可能为Al或Cl2
C.Y一定为NaOH(aq) D.Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源:2011年陕西省咸阳市高考化学模拟试卷(二)(解析版) 题型:解答题
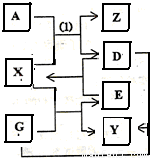
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com