
【题目】填空
(1)1.7gNH3与标况下_________LH2S中的氢原子数相同
(2)在标准状况((___________)℃ 、_____________KPa)下,CO和CO2的混合气体共4.48L,质量为7.2g。则两种气体的物质的量之和为____________mol,该混合气体的平均相对分子质量为___________,其中CO2为___________g.
【答案】3.36L 0 101 0.2 36 4.4
【解析】
(1)根据![]() ,计算出1.7gNH3中氢原子的物质的量,根据
,计算出1.7gNH3中氢原子的物质的量,根据![]() 计算出V;
计算出V;
(2)根据标况的定义回答,根据![]() 计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的质量,依据
计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的质量,依据![]() ,计算混合气体平均相对分子质量。
,计算混合气体平均相对分子质量。
(1)根据![]() ,1.7g NH3的物质的量为0.1mol,一个氨分子含有三个氢原子,0.1molNH3含有0.3mol氢原子,一个硫化氢分子含有两个氢原子,0.3mol氢原子与0.15molH2S气体含有的氢原子数相同,根据
,1.7g NH3的物质的量为0.1mol,一个氨分子含有三个氢原子,0.1molNH3含有0.3mol氢原子,一个硫化氢分子含有两个氢原子,0.3mol氢原子与0.15molH2S气体含有的氢原子数相同,根据![]() ,即与标准状况下
,即与标准状况下![]() =0.15mol×22.4L/mol=3.36L气体含有的氢原子数相同;
=0.15mol×22.4L/mol=3.36L气体含有的氢原子数相同;
(2)标况下指的是0℃、101KPa下,1mol任何气体在标况下的体积都是22.4L;4.48L标况下气体物质的量为![]() ,设CO物质的量为x,CO2物质的量为y,则x+y=0.2,28x+44y=7.2,解得x=0.1mol,y=0.1mol,则二氧化碳质量为0.1mol×44g/mol=4.4g,一氧化碳的质量为0.1mol×28g/mol=2.8g,混合气体的总质量为7.2g,混合气体的平均摩尔质量为
,设CO物质的量为x,CO2物质的量为y,则x+y=0.2,28x+44y=7.2,解得x=0.1mol,y=0.1mol,则二氧化碳质量为0.1mol×44g/mol=4.4g,一氧化碳的质量为0.1mol×28g/mol=2.8g,混合气体的总质量为7.2g,混合气体的平均摩尔质量为![]() ,所以相对分子质量为36。
,所以相对分子质量为36。


科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.标况下,16gCH4含有分子数目为NA个
B.0.1 mol·L1氯化钠溶液含有的Na+数目为0.1NA
C.1 molH2O中含有质子数为10NA个
D.标况下,22.4L空气中含有分子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据如图所示的电解水原理进行实验,观察不同时间试管内的气体体积变化,则甲试管生成的气体是_______。

(2)假设电解了36g水,根据电解水的化学反应式计算生成氢气、氧气质量各为__________g;若在标况下,生成氢气、氧气体积各为_______________?
(3)根据实验观察和推算_______(“能”或“否”)得出初步结论:在相同温度和压强下,不同体积的O2和H2的其体积比等于其物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请直接用计算结果填空:
(1)标准状况下,测定1.32g某气体X的体积为0.672L,则X的摩尔质量为__。
(2)已知5.1g镁铝合金与100mL某浓度的盐酸恰好完全反应,得到5.6L氢气(标准状况下)。则:①生成的H2分子的数目是__NA。
②该合金中镁和铝的物质的量之比为__。
③上述盐酸的物质的量浓度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳能与氢、氮、氧三种元素组成化合物CO(NH2)2,该物质易溶于水的主要原因是____。
(2)碳元素能形成多种无机物。
①CO32-的立体构型是________。
②MgCO3分解温度比CaCO3低的原因是___________。
(3)图①为嘌呤的结构,嘌呤中轨道之间的夹角∠1比∠2大,请解释原因:____________。
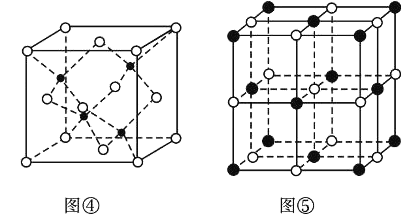
(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有![]() 键的数目为________。
键的数目为________。
(5)图③为碳的另一种同素异形体一一金刚石的晶胞结构,其中原子坐标参数A为(0,0,0),B为(![]() ),C为(
),C为(![]() );则D原子的坐标参数为________。
);则D原子的坐标参数为________。
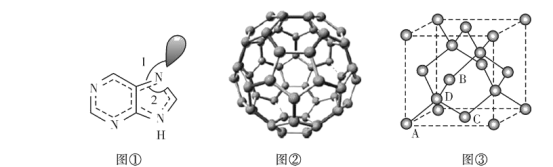
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图①所示,其中(〇为Se,●为Mn),则Se的配位数为____,Mn和Se的摩尔质量分别为M1 g/mol、M2 g/mol,该晶体的密度为![]() g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
g/cm3,则Mn-Se键的键长为_____nm(写表达式即可)。
(7)KI的晶胞结构如图⑤所示,已知其晶体的密度为![]() g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
g/cm3,K和I的摩尔质量分别为Mk gmol-1和MI gmol-1,原子半径分别为rk pm和rI pm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为______(写表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。
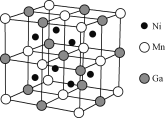
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com