
| A. | 氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,金刚石比石墨稳定 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.反应自发进行的判断依据是△H-T△S<0;
C.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol;
D.物质能量越高越活泼,焓变为正值说明反应过程是吸热反应.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,所以水分解的热化学方程式:H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.5 kJ•mol-1,但是电解水的热化学方程式中,根据能量守恒,电能的介入会导致热能减少,吸收的热量变小,故A错误;
B.反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,满足△H-T△S<0,反应△S<0,则该反应的△H<0,故B正确;
C.0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故C错误;
D.由C(石墨,s)=C(金刚石,s)△H=+1.90 k•Jmol-1可知,反应过程是吸热反应,金刚石能量高于石墨,则说明石墨比金刚石稳定,故D错误;
故选B.
点评 本题考查了燃烧热概念、可逆反应、反应自发进行的判断依据等知识点,注意能量的变化形式,物质能量越高越活泼,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
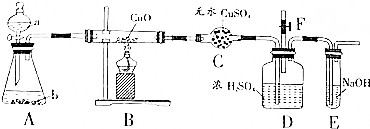
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g) | |
| B. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=+183KJ•mol-1 | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ•mol-1 | |
| D. | 氢气和氯气反应生成1mol氯化氢气体,反应的△H=+183KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
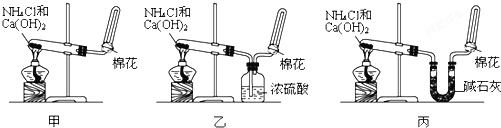
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
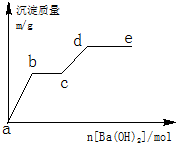 在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.
在含有0.4molHCl和0.1molMgSO4的混合溶液中逐滴加入Ba(OH)2 溶液,产生的沉淀质量m与加入Ba(OH)2的物质的量n之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.225mol/L | D. | 0.30mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KMnO4被氧化 | |
| B. | 反应中得到电子的物质是Cl2 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 被还原的HCl占参加反应HCl物质的量的3/8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com