
【题目】常温下,向20 mL 0.1 mol·L-1 HCN溶液中滴加0.1 mol·L-1NaOH的溶液,由水电离的氢氧根离子浓度随加入NaOH体积的变化如图所示,则下列说法正确的是 ( )
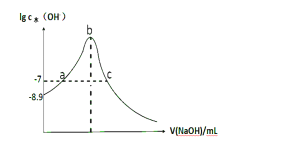
A.常温下,0.1 mol·L-1HCN的电离常数 K a数量级为10-8
B.a、c两点溶液均为中性
C.当 V(NaOH)=10mL时:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D.当V(NaOH)=30mL时:2c(OH-)-2c(H+)=c(CN-)+3c(HCN)
【答案】D
【解析】
A. 常温下,0.1 mol·L-1HCN溶液中,水电离出的氢离子浓度为10-8.9mol/L,则溶液中的氢离子浓度=![]() =10-5.1,则电离常数 Ka=
=10-5.1,则电离常数 Ka=![]() =10-9.2,数量级为10-,9,故A错误;
=10-9.2,数量级为10-,9,故A错误;
B. a点为HCN和NaCN的混合溶液显中性,c点为NaOH和NaCN的混合溶液呈碱性,故B错误;
C. 当 V(NaOH)=10mL时,为HCN和NaCN的混合溶液且二者物质的量浓度相等,溶液显酸性,c(OH-)<c(H+),故C错误;
D. 当V(NaOH)=30mL时,为NaOH和NaCN的混合溶液呈碱性,钠离子的总物质的量为0.003mol,NaCN中CN-以CN-和HCN两种形式存在,总物质的量为0.002mol,则物料守恒为2c(Na+)=3c(CN-)+3c(HCN),该混合溶液中电荷守恒式为:c(Na+)+ c(H+)= c(CN-)+ c(OH-),则c(Na+)= c(CN-)+ c(OH-)- c(H+),代入物料守恒式,可得:2[c(CN-)+ c(OH-)- c(H+)]=3c(CN-)+3c(HCN),2c(OH-)-2c(H+)=c(CN-)+3c(HCN),故D正确;
答案选D。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.已知固体A受热易分解,实验流程和结果如下:
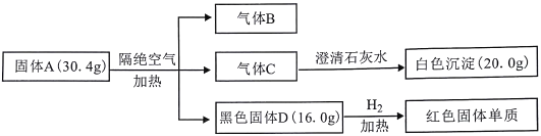
B和C为常见气体且所含元素相同。气体C在标准状况下密度为1.96g·L-1。请回答:
(1)白色沉淀的化学式____________。
(2)写出A受热分解的化学方程式___________________________。
(3)取少量固体D溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。写出产生该现象的离子方程式_________。
Ⅱ.已知甲烷实验室可用CH3COONa(s)和NaOH(s) 为原料制取,装置如图下。请回答:
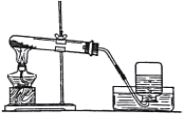
(1)写出发生装置中的反应______________________________。
(2)气体收集完毕后,接下来的操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物合成中间体F制备路线如下:
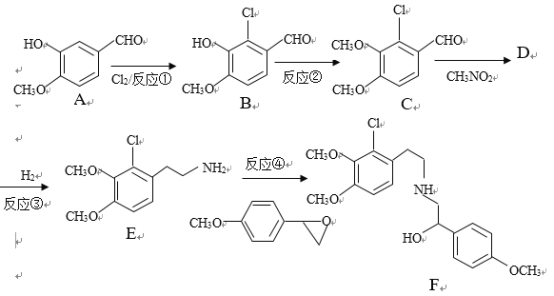
已知:RCHO+R’CH2NO2![]()
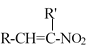 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
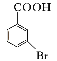 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
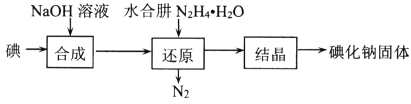
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
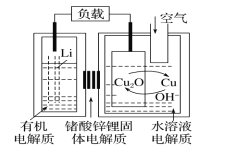
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2(反应主要装置如图一所示,其它装置省略)。当盐酸达到一个临界浓度时,反应就会停止。为测定反应残余液中盐酸的临界浓度,探究小组同学提出了下列实验方案:
甲方案:将产生的Cl2与足量AgNO3溶液反应,称量生成的AgCl质量,再进行计算得到余酸的量。
乙方案:采用酸碱中和滴定法测定余酸浓度。
丙方案:余酸与已知量CaCO3(过量)反应后,称量剩余的CaCO3质量。
丁方案:余酸与足量Zn反应,测量生成的H2体积。
具体操作:装配好仪器并检查装置气密性,接下来的操作依次是:
①往烧瓶中加入足量MnO2粉末
②往烧瓶中加入20mL 12molL-1浓盐酸
③加热使之充分反应。
(1)在实验室中,该发生装置除了可以用于制备Cl2,还可以制备下列哪些气体______?
A. O2 B. H2 C. CH2=CH2 D. HCl
若使用甲方案,产生的 Cl2必须先通过盛有 ________(填试剂名称)的洗气瓶, 再通入足量 AgNO3溶液中,这样做的目的是 ______________;已知AgClO易溶于水,写出Cl2与AgNO3溶液反应的化学方程式________________
(2)进行乙方案实验:准确量取残余清液,稀释5倍后作为试样。准确量取试样25.00mL,用1.500mol·L-1NaOH标准溶液滴定,选用合适的指示剂,消耗NaOH标准溶液23.00mL,则由此计算得到盐酸的临界浓度为 ____ mol·L-1(保留两位有效数字);选用的合适指示剂是 _____。
A 石蕊 B 酚酞 C 甲基橙
(3)判断丙方案的实验结果,测得余酸的临界浓度_________ (填偏大、偏小或―影响)。(已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11)
(4)进行丁方案实验:装置如图二所示(夹持器具已略去)。
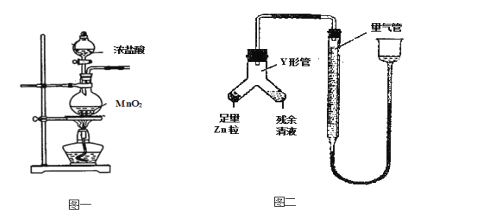
(i)使Y形管中的残余清液与锌粒反应的正确操作是倾斜Y形管,将 _____转移到_____中。
(ii)反应完毕,需要读出量气管中气体的体积,首先要___________,然后再______,最后视线与量气管刻度相平。
(5)综合评价:事实上,反应过程中盐酸浓度减小到临界浓度是由两个方面所致,一是反应消耗盐酸,二是盐酸挥发,以上四种实验方案中,盐酸挥发会对哪种方案带来实验误差(假设每一步实验操作均准确)?____________
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄是一种常见水果,可以生食或制作葡萄干,除此之外,葡萄还可用于酿酒。
(1)检验葡萄汁含有葡萄糖的方法是:向其中加碱调至碱性,再加入新制的Cu(OH)2并加热,其现象是________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式:C6H12O6(葡萄糖)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)葡萄酒密封储存过程中会生成有香味的酯类,酯类也可以通过化学实验来制备,实验室可用如图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是__________。
②试管b中盛放的试剂是饱和____________溶液。
③实验开始时,试管b中的导管不伸入液面下的原因是________。
④若要分离出试管b中的乙酸乙酯,需要用到的仪器是_______(填字母)。
A.普通漏斗 B.分液漏斗 C.长颈漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明硫的非金属性比氯弱的事实有
①![]() 与铁反应生成
与铁反应生成![]() ,S与铁反应生成FeS
,S与铁反应生成FeS
②![]() 和
和![]() 的混合气,经强光照射可剧烈反应,而S与
的混合气,经强光照射可剧烈反应,而S与![]() 反应需较高温度
反应需较高温度
③将![]() 通入氢硫酸中可置换出硫
通入氢硫酸中可置换出硫
④常温时硫单质为固态而氯单质为气态.
A.①③B.①②③C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
A.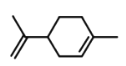 和
和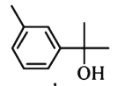 都属于芳香族化合物
都属于芳香族化合物
B. 和
和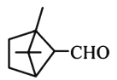 分子中所有碳原子均处于同一平面上
分子中所有碳原子均处于同一平面上
C. 、
、 和
和 均能使酸性
均能使酸性![]() 溶液褪色
溶液褪色
D. 和
和 均能与新制的
均能与新制的![]() 反应生成红色沉淀
反应生成红色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com