
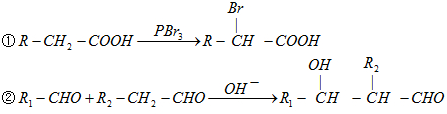
| 134×35.8% |
| 12 |
| 134×4.48% |
| 1 |
| 134-12×4-6 |
| 16 |
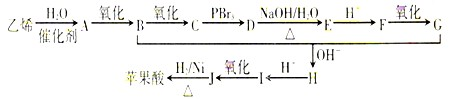
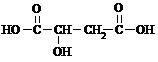 ,乙烯与水发生加成反应生成A为CH3CH2OH,A连续发生氧化反应生成C,则B为CH3CHO,C为CH3COOH,由反应信息①可知,羧基连接的碳原子上的氢原子被溴原子取代,故D为Br-CH2-COOH,D发生水解反应生成E为HO-CH2-COONa,E酸化得到F为HO-CH2-COOH,F发生氧化反应得到G为HOOC-CHO,G与乙醛发生信息②中醛的加成反应生成H为
,乙烯与水发生加成反应生成A为CH3CH2OH,A连续发生氧化反应生成C,则B为CH3CHO,C为CH3COOH,由反应信息①可知,羧基连接的碳原子上的氢原子被溴原子取代,故D为Br-CH2-COOH,D发生水解反应生成E为HO-CH2-COONa,E酸化得到F为HO-CH2-COOH,F发生氧化反应得到G为HOOC-CHO,G与乙醛发生信息②中醛的加成反应生成H为 ,H酸化得到I为
,H酸化得到I为 ,I发生氧化反应得到J为
,I发生氧化反应得到J为 ,J与氢气发生加成反应得到苹果酸,据此解答.
,J与氢气发生加成反应得到苹果酸,据此解答.| 134×35.8% |
| 12 |
| 134×4.48% |
| 1 |
| 134-12×4-6 |
| 16 |
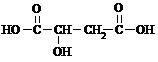 ,乙烯与水发生加成反应生成A为CH3CH2OH,A连续发生氧化反应生成C,则B为CH3CHO,C为CH3COOH,由反应信息①可知,羧基连接的碳原子上的氢原子被溴原子取代,故D为Br-CH2-COOH,D发生水解反应生成E为HO-CH2-COONa,E酸化得到F为HO-CH2-COOH,F发生氧化反应得到G为HOOC-CHO,G与乙醛发生信息②中醛的加成反应生成H为
,乙烯与水发生加成反应生成A为CH3CH2OH,A连续发生氧化反应生成C,则B为CH3CHO,C为CH3COOH,由反应信息①可知,羧基连接的碳原子上的氢原子被溴原子取代,故D为Br-CH2-COOH,D发生水解反应生成E为HO-CH2-COONa,E酸化得到F为HO-CH2-COOH,F发生氧化反应得到G为HOOC-CHO,G与乙醛发生信息②中醛的加成反应生成H为 ,H酸化得到I为
,H酸化得到I为 ,I发生氧化反应得到J为
,I发生氧化反应得到J为 ,J与氢气发生加成反应得到苹果酸,
,J与氢气发生加成反应得到苹果酸,| 水 |
| △ |
| 水 |
| △ |
 +2NaHCO3→
+2NaHCO3→ +2CO2↑+2H2O,
+2CO2↑+2H2O, +2NaHCO3→
+2NaHCO3→ +2CO2↑+2H2O;
+2CO2↑+2H2O; 、
、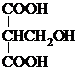 ,
, 、
、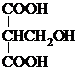 .
.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| A、X、M两种元素只能形成X2M型化合物 |
| B、元素Y、Z、W的单质晶体属于同种类型的晶体 |
| C、元素W和M的某些单质可作为水处理中的消毒剂 |
| D、由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LCH2Cl2中含C-Cl键数目为0.2NA |
| B、常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA |
| C、常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA |
| D、常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
A、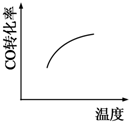 |
B、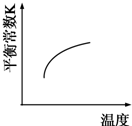 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
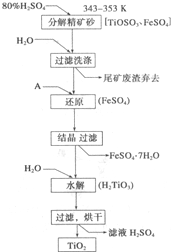 钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.如图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题:
钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.如图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2CO3溶液中:c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+) |
| B、常温时,将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)=0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(NO3)2 溶液中:SO2、Na+、NH4+、CH3COO- |
| B、Kw/c(H+)=0.1mol/L-1的溶液中:K+、Ba2+、C1-、HCO3- |
| C、FeCl2溶液中:H2O2、Mg2+、H+、Cl- |
| D、含苯酚的水溶液中用::Al3+、NH4+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
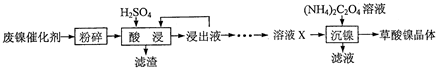
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
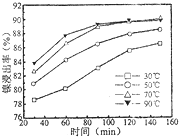
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 滴加氯水和CCl4,震荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| B | 向NaI溶液中先滴加少量AgNO3溶液,后滴加少量Na2S溶液 | 先有黄色沉淀,后变成黑色沉淀 | Ksp(Ag2S)比Ksp(AgI)大 |
| C | 将SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| D | 向淀粉溶液中加稀硫酸,加热,取出水解液少许,滴加银氨溶液,并水浴加热 | 没有有银镜出现 | 淀粉没有发生水解 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com