
依据事实,写出下列反应的热化学方程式.
(1)1molN2(g)与适量O2(g)反应生成NO2(g),吸收68kJ热量: ;
(2)1molCu(s)与适量O2(g)反应生成CuO(s),放出157kJ热量: ;
(3)卫星发射时可用肼(N2H4)作燃料,1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量:
(4)10g C2H6(g)完全燃烧生成CO2(g)和H2O(l),放出a kJ热量,写出表示C2H6燃烧热的热化学方程式:
(5)已知:WO2(s)+2H2(g)═W(s)+2H2O(g)△H=+66.0kJ/mol;WO2(g)+2H2(g)═W(s)+2H2O(g)△H=﹣137.9kJ/mol.则WO2(s)═WO2(g)的△H=
(6)已知:Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ/mol,2Al(l)+AlCl3(g)═3AlCl(g)△H=b kJ/mol,则反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H= J/mol(用含a、b的代数式表示).
考点: 用盖斯定律进行有关反应热的计算;热化学方程式.
分析: (1﹣4)根据热化学方程式的书写原则写出热化学方程式,方程中的热量和化学计量数要对应;
(5)依据盖斯定律,将题中所给两方程式相减得WO2(s)═WO2(g);
(6)根据盖斯定律,将题中所给两方程式相减得Al2O3(s)+3C(s)=2Al(l)+3CO(g).
解答: 解:(1)1mol N2 (g)与适量O2(g)起反应,生成NO2(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
(2)放热时焓变值为负值,1mol Cu(s)与适量O2(g)起反应,生成CuO(s),放出157kJ热量的热化学方程式为Cu(s)+ O2(g)=CuO(s);△H=﹣157kJ/mol,故答案为:Cu(s)+
O2(g)=CuO(s);△H=﹣157kJ/mol,故答案为:Cu(s)+ O2(g)=CuO(s)△H=﹣157kJ/mol;
O2(g)=CuO(s)△H=﹣157kJ/mol;
(3)1mol N2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出622kJ热量放热时焓变值为负值,所以该反应的热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol,
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣622kJ/mol;
(4)10gC2H6(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出akJ热量,则1molC2H6(l)在与O2(g)中燃烧,生成CO2(g)和H2O(l),放出热量为
 ×30=3aKJ,该反应的热化学方程式为C2H6(l)+
×30=3aKJ,该反应的热化学方程式为C2H6(l)+ O2(g)=2CO2(g)+3H2O(l)△H=﹣3akJ/mol;
O2(g)=2CO2(g)+3H2O(l)△H=﹣3akJ/mol;
故答案为:C2H6(l)+ O2(g)=2CO2(g)+3H2O(l)△H=﹣3akJ/mol;
O2(g)=2CO2(g)+3H2O(l)△H=﹣3akJ/mol;
(5)①WO2(s)+2H2(g)⇌W(s)+2H2O(g);△H=+66.0kJ•mol﹣1
②WO2(g)+2H2(g)⇌W(s)+2H2O(g);△H=﹣137.9kJ•mol﹣1
依据盖斯定律①﹣②得到WO2(s)⇌WO2(g)的△H=+203.9kJ/mol;
故答案为:+203.9 kJ•mol﹣1;
(6)已知:①Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
②2Al(l)+AlCl3(g)═3AlCl(g)△H=b kJ/mol
根据盖斯定律,①﹣②得Al2O3(s)+3C(s)=2Al(l)+3CO(g),对应的△H=(a﹣b)kJ•mol﹣1,
故答案为:a﹣b.
点评: 本题考查了热化学方程式书写和盖斯定律的计算应用,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.


科目:高中化学 来源: 题型:
关于铅蓄电池的说法正确的是()
A. 在放电时,正极发生的反应是Pb(s)+SO42﹣(aq)﹣2e﹣=PbSO4(s)
B. 在放电时,该电池的负极材料是铅板
C. 在充电时,电池中硫酸的浓度不断变小
D. 在充电时,阳极发生的反应是P bSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)
bSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于燃烧热的说法中正确的是()
A. 1 mol物质燃烧所放出的热量
B. 常温下,可燃物燃烧放出的热量
C. 在25℃、1.01×105Pa时,1mol纯物质燃烧生成稳定的氧化物时所放出的热量
D. 燃烧热随化学方程式前的化学计量数的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,△H1>△H2的是()
A. 2H2(g)+O2(g)═2H2O(l)△H1;2H2(g)+O2(g)═2H2O(g)△H2
B. S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2
C. C(s)+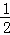 O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1;C(s)+O2(g)═CO2(g)△H2
D. H2(g)+Cl2(g)═2HCl(g)△H1;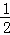 H2(g)+
H2(g)+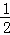 Cl2(g)═HCl(g)△H2
Cl2(g)═HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
有三支试管,分别加入下列物质后甲:10mL 0.01mol/L FeCl3溶液和10mL 0.01mol/L KSCN溶液乙:5mL水、10mL 0.01mol/L FeCl3溶液5mL 0.01mol/L KSCN溶液丙:10mL 0.1mol/L FeCl3溶液和10mL 0.1mol/L KSCN溶液观察这三支试管的颜色,其中颜色最浅的是()
A. 甲试管 B. 乙试管 C. 丙试管 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是()
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
三草酸合铁酸钾(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.
完成下列填空:
某实验小组为测定该晶体中铁的含量和结晶水的含量,做了如下实验:
(一)铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL 于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液将草酸根恰好全部氧化成CO2,MnO4﹣同时被还原为Mn2+.向反应后的溶液中加入锌粉,加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4﹣被还原成Mn2+.
重复步骤二和步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98mL.
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、冷却、转移、洗涤并转移、 、摇匀.
(2)加入锌粉的目的是 .
(3)写出步骤三中发生反应的离子方程式 .
(4)实验测得该晶体中铁的质量分数为 .在步骤二中,若滴加的KMnO4溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”或“不变”)
(二)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.
(5)请纠正上述实验过程中的两处错误: .
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)147gH2SO4中含 mol原子,与 g CO2所含有的氧原子数相同.
标准状况下,2.4g某气体的体积为672mL,则此气体的相对分子质量为 .
(3)在标准状况下,V L氨气溶于1L水中,所得溶液的密度为ρg•cm﹣3,溶液的质量分数为ω.则此溶液的物质的量浓度为: 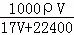 或
或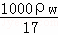 mol/L
mol/L
(4)将Wg胆矾(CuSO4 •5H2O )溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,则溶液的物质的量浓度为 mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com