
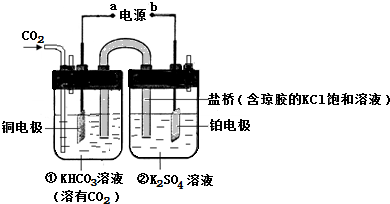
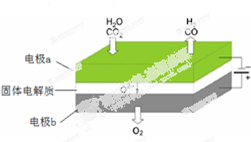
分析 (1)在电解池的阳极上,是阴离子发生失电子的氧化反应,在电解池的阴极上发生二氧化碳得电子的还原反应,CO2电催化还原为CH4的过程CO2+8H++8e-═CH4+2H2O是一个还原反应过程,据此回答;
(2)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气.
解答 解:(1)在电解池的阳极上,是阴离子氢氧根离子发生失电子的氧化反应,所以酸性增强,pH一定下降,即②池中溶液的pH降低;在电解池的阴极上发生二氧化碳得电子的还原反应,即CO2+8H++8e-═CH4+2H2O,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小,CO2电催化还原为CH4的过程是一个还原反应过程,所以铜电解是电解池的阴极,铜电极的电极反应式为CO2+8H++8e-═CH4+2H2O,
故答案为:降低;电解池的阴极上发生二氧化碳得电子的还原反应,即CO2+8H++8e-═CH4+2H2O,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以n(KHCO3)会减小;CO2+8H++8e-═CH4+2H2O;
(2)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,
故答案为:CO2+2e-═CO+O2-.
点评 本题考查学生电解池的工作原理知识,注意两极反应式的书写以及氧化还原反应之间的关系,注意规律的总结是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
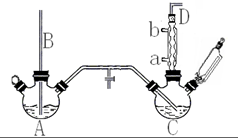 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaClO | C. | NaCl | D. | Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na被完全氧化生成Na2O2,失去2NA个电子 | |
| B. | 常温常压下,18 g H2O 中含有的原子总数为3NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| D. | 1 mol Cl2与1 mol Fe反应,转移的电子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com