
【题目】用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)仔细观察实验装置,图中是否缺少一种玻璃仪器,如果缺少,缺少的是______________(填仪器名称,如果不缺少,此空不填),图中是否有不妥之处,如果有请指出:________________________(如果没有,此空不填)。
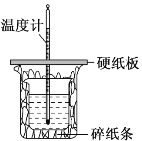
(2)大烧杯上如不盖硬纸板,求得的中和热ΔH将______(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”或“不相等”),简述理由:____________________________。
【答案】环形玻璃搅拌棒 大烧杯口与小烧杯口不相平,且未填满碎纸条 偏大 相等 中和热是一个定值,与实验中药品的用量多少无关
【解析】
(1)实验测定过程中要使用环形玻璃棒进行搅拌保证反应快速彻底进行;中和热测定实验成败的关键是保温工作;
(2)不加盖纸板,热量会散失,测定中和反应放出的热量数值偏小,放热反应焓变小于0;
(3)根据中和热定义分析解答。
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大烧杯口与小烧杯口不相平,且未填满碎纸条;
(2)大烧杯上如不盖硬纸板,会有部分热量散失,则求得的中和热数值偏小,中和反应为放热反应,焓变小于0,ΔH偏大;
(3)如果用60mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1NaOH溶液进行反应,与上述实验相比,反应生成的水增多,则所放出的热量也增多;根据中和热的定义可知,中和热是指生成1mol水放出的热量,经折算后,最终求出的中和热是相等的。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热可得到无水AlCl3,试用相关化学原理与必要的化学方程式进行解释。已知液态化合物SOCl2遇水剧烈反应,生成SO2和HCl两种气体。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置 氧化废液中的溴化氢
氧化废液中的溴化氢
B.用装置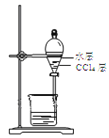 分离油层和水层
分离油层和水层
C.用装置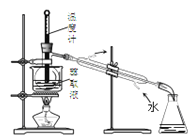 分离四氯化碳和液溴
分离四氯化碳和液溴
D.用仪器 密封存放单质溴
密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所示物质的制备方法合理的是
A.实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏
B.金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭![]() TiCl4
TiCl4![]() Ti
Ti
C.从卤水中(溶质主要是MgCl2)提取Mg:卤水![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s) ![]() Mg
Mg
D.由食盐制取漂粉精NaCl(ag) ![]() Cl2
Cl2![]() 漂粉精
漂粉精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的自然资源,从海水中可以提取多种化工原料,如图是某工厂对海水综合利用的示意图:
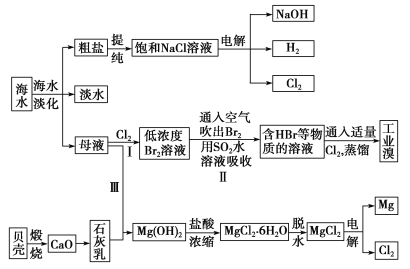
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。则加入试剂的先后顺序是________(填编号)。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_____________。步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式:_______________________。
(3)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入MgCl2溶液,充分搅拌后经________(填操作方法)可得纯净的Mg(OH)2。
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是________(填字母)。
A.H2 B.CO2 C.N2 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe5O7B.Fe2O3C.Fe3O4D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得“863”和中科院“百人计划”支持的绿色环保型铝碘电池已研制成功。电极为铝、石墨,电解液为AlI3溶液,电池总反应:2AlI3 ![]() 2Al +3I2,下列说法中正确的是( ):
2Al +3I2,下列说法中正确的是( ):
A. 放电时的负极反应Al-3e-=Al3+,导线中通过3.612×1024个电子时负极质量减少27g
B. 充电时电子的流动方向:电源负极→Al电极→电解质溶液→石墨电极→电源正极
C. 消耗相同质量的金属时,用锂做负极转移电子的物质的量比用铝时的多
D. 乙醇、乙酸等含活泼氢的有机物可用作该铝碘电池的电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com