
 某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):
某校课外活动小组的同学在完成课本乙醇氧化制乙醛的实验后,改进了实验方案(如图),进行如下实验操作(顺序已打乱):分析 (1)该实验目的是探究乙醇氧化制乙醛,根据实验目的和节约药品的原则分析实验操作顺序;
(2)根据装置e为球形漏斗结合实验产物性质分析;
(3)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;
(4)乙醛中具有还原性的醛基,被新制的银氨溶液氧化;
(5)乙醛和新制氢氧化铜的反应本质是乙醛还原新制的氢氧化铜得到砖红色的沉淀,本身被氧化为乙酸,这个实验的关键是必须保持在碱性环境下发生;
(6)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应.
解答 解:(1)该实验目的是探究乙醇氧化制乙醛,首先是③连接好仪器,检验装置的气密性;然后④正确添加试剂;乙醇和铜不反应,和氧化铜反应,所以要先制取氧化铜;不加热时,铜和氧气不反应,造成资源浪费,所以先⑤点燃C装置中的酒精灯加热铜,②向圆底烧瓶中滴加10%过氧化氢溶液制取氧气,
铜生成氧化铜后,再①点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热,制取乙醇蒸汽,所以实验操作顺序为③④⑤②①,
故答案为:③④⑤②;
(2)D为乙醛,易溶于水,装置e为球形漏斗,球形部分体积大,能防止倒吸,同时冷凝收集产品,
故答案为:冷凝收集产品,并防止倒吸;
(3)乙醇的催化氧化反应过程:金属铜被氧气氧化为氧化铜,2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,氧化铜将乙醇氧化为乙醛,CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O,
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CH3CHO+Cu+H2O;
(4)醛基能被弱氧化剂氧化为羧基,用银氨溶液检验D中官能团的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(5)本实验中试剂的量:2mL5%的CuSO4,滴加4-5滴NaOH溶液,根据反应:CuSO4+2NaOH═Cu(OH)2↓+2NaSO4,可知:当n(NaOH)<2n(CuSO4),硫酸铜过量,而本实验要求碱过量,再滴加几滴D中溶液,在酒精灯上加热,未出现砖红色沉淀,新制的氢氧化铜中碱不足,易导致该实验失败,无法说明没有乙醛生成,
故答案为:不合理,新制的氢氧化铜中碱不足,易导致该实验失败,无法说明没有乙醛生成;
(6)若试管中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏.
点评 本题考查了乙醇的化学性质,题目难度中等,注意掌握物质性质和实验基本操作方法是解题本题关键,明确乙醇的催化氧化原理,易错题是(1)题,要根据实验目的及实验节约的原则排序.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2-甲基-3-丙基戊烷 | B. | 3-异丙基己烷 | ||
| C. | 2-甲基-3-乙基己烷 | D. | 5-甲基-4-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物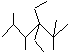 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 酯类物质是形成水果香味的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应,只要化学反应的速率很快,理论上都能设计成原电池 | |
| B. | 中和反应一定是放热反应 | |
| C. | 化学反应的速率可通过改变条件而改变 | |
| D. | 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4 mol | B. | 4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | Na2CO3溶液中:c(OH-)+2 c(CO32-)+c(HCO3-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酒精灯打翻在实验台上失火时,立即用湿抹布盖灭 | |
| B. | 不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积水,而后边搅拌边慢慢加入浓硫酸 | |
| D. | 做实验时不准直接用手接触药品、不准尝试药品、不准直接闻气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com