
【题目】Ⅰ.下列8种化学符号:![]() O2、
O2、![]() O3、
O3、![]() H、
H、![]() C、
C、![]() Na、
Na、![]() N、
N、![]() C、
C、![]() Mg。
Mg。
(1)表示核素的符号共_____种。
(2)互为同位素的是______,质量数相等的是_______,中子数相等的是____。
(3)质量相同的H216O和D216O所含中子数之比为________。
Ⅱ.根据周期表对角线规则,金属Be与Al的单质及其化合物的性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式____________
(5)Be(OH)2与Mg(OH)2可用_________鉴别。
Ⅲ.铜有两种天然同位素 ![]() Cu和
Cu和![]() Cu,参考铜的相对原子质量(63.5)。
Cu,参考铜的相对原子质量(63.5)。
(6)计算![]() Cu的质量百分含量约是_________。(保留3位有效数字)
Cu的质量百分含量约是_________。(保留3位有效数字)
【答案】6 ![]() C
C![]() C
C ![]() N、
N、![]() C
C ![]() Na、
Na、![]() Mg 8:9 Be+2OH-+2H2O=[Be(OH)4]2-+H2↑ 氢氧化钠溶液 25.6%
Mg 8:9 Be+2OH-+2H2O=[Be(OH)4]2-+H2↑ 氢氧化钠溶液 25.6%
【解析】
(1)核素是指具有一定数目的质子和一定数目的中子的一种原子;
(2)质子数相同而中子数不同的同一元素的不同原子互称同位素;
(3)先计算两种分子的中子数,再依据等质量计算所含中子数之比;
(4)Be与氢氧化钠溶液反应生成Na2[Be(OH)4]和氢气;
(5)Be(OH)2与氢氧化铝性质相似为两性氢氧化物,能溶于强酸强碱,Mg(OH)2为中强碱,溶于强酸,不溶于强碱;
(6)先计算![]() Cu和
Cu和![]() Cu的物质的量比,再依据物质的量比计算质量百分含量。
Cu的物质的量比,再依据物质的量比计算质量百分含量。
(1)核素是指具有一定数目的质子和一定数目的中子的一种原子,属于原子的有![]() H、
H、![]() C、
C、![]() Na、
Na、![]() N、
N、![]() C、
C、![]() Mg,它们都表示核素,即共有6种核素,故答案为:6;
Mg,它们都表示核素,即共有6种核素,故答案为:6;
(2)质子数相同而中子数不同的同一元素的不同原子互称同位素,在8种微粒中![]() C和
C和![]() C质子数都是6,中子数分别为7和8,互为同位素;
C质子数都是6,中子数分别为7和8,互为同位素;![]() N和
N和![]() C的质量数都为14;
C的质量数都为14;![]() Na的中子数为(23—11)=12,
Na的中子数为(23—11)=12,![]() Mg的中子数为(24—12)=12,两者中子数相同,故答案为:
Mg的中子数为(24—12)=12,两者中子数相同,故答案为:![]() C、
C、![]() C;
C;![]() N、
N、![]() C;
C;![]() Na、
Na、![]() Mg;
Mg;
(3)H216O的摩尔质量为18g/mol,中子数为2×0+(16—8)=8,D216O的摩尔质量为20g/mol,中子数为2×1+(16—8)=10,质量相同的H216O和D216O所含中子数之比为(8×![]() ):(10×
):(10×![]() )=8:9,故答案为:8:9;
)=8:9,故答案为:8:9;
(4)金属Be与Al的单质及其化合物的性质相似可知,Be与氢氧化钠溶液反应生成Na2[Be(OH)4]和氢气,反应的离子方程式为Be+2OH-+2H2O=[Be(OH)4]2-+H2↑,故答案为:Be+2OH-+2H2O=[Be(OH)4]2-+H2↑;
(5)Be(OH)2与氢氧化铝性质相似为两性氢氧化物,能溶于强酸强碱,Mg(OH)2为中强碱,溶于强酸,不溶于强碱,则可用氢氧化钠溶液鉴别Be(OH)2与Mg(OH)2,故答案为:氢氧化钠溶液;
(6)设![]() Cu的物质的量分数为a,则
Cu的物质的量分数为a,则![]() Cu的物质的量分数为(1—a),由铜的相对原子质量为63.5可得65a+63(1—a)=63.5,解得a=0.25,
Cu的物质的量分数为(1—a),由铜的相对原子质量为63.5可得65a+63(1—a)=63.5,解得a=0.25,![]() Cu和
Cu和![]() Cu的物质的量比为0.25:0.75=1:3,则
Cu的物质的量比为0.25:0.75=1:3,则![]() Cu的质量百分含量为
Cu的质量百分含量为![]() ×100%≈25.6%,故答案为:25.6%。
×100%≈25.6%,故答案为:25.6%。


科目:高中化学 来源: 题型:
【题目】反应4NH3 + 5O2 === 4NO + 6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:( )
A.v (O2)=0.01 mol/(L·s)B.v (NO)=0.008 mol/(L·s)
C.v (H2O)=0.015 mol/(L·s)D.v (NH3)=0.002 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯 (![]() ) 与(3)-轴烯 (
) 与(3)-轴烯 (![]() )的说法错误的是
)的说法错误的是
A.二者互为同分异构体
B.二者可用酸性KMnO4溶液鉴别
C.(3)-轴烯与足量H2反应所得产物的二氯代物有5种
D.苯分子中所有原子共平面,(3)-轴烯分子中所有原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:
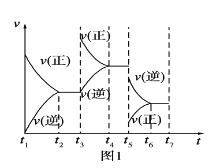
(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
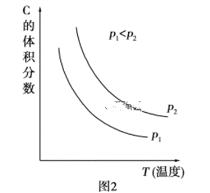
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为外电源,![]() 作阳极、
作阳极、![]() 作阴极,电解稀硫酸,使铝表面的氧化膜增厚。已知:
作阴极,电解稀硫酸,使铝表面的氧化膜增厚。已知:
铅蓄电池中的总反应方程式为:![]()
电解的化学方程式: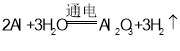
对该电解过程,下列判断错误的是( )
A.电解池:溶液的![]() 减小
减小
B.电解池: ![]() 移向
移向![]() 电极
电极
C.铅蓄电池:负极质量不变
D.铅蓄电池:工作一段时间后,进行充电时铅蓄电池的负极接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增大CO的浓度B.降低温度C.升高温度D.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g碳酸钠、氢氧化钠的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中正确的是( )
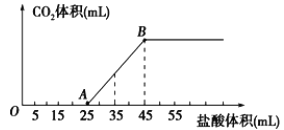
A.OA段发生反应的离子方程式为:H++OH-→H2O
B.B当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、Na2CO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以![]() 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.58.5 g氯化钠固体中含有![]() 个氯化钠分子
个氯化钠分子
B.1 mol Fe参与反应失去电子数目一定为2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 个电子
个电子
D.常温下,46 g N02和N204的混合物中含有的氮原子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com