
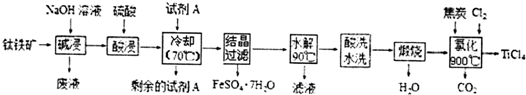
分析 钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、Fe2O3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、Fe2(SO4)3、FeSO4及未反应的硫酸等,加入试剂A后冷却、结晶、过滤得到硫酸亚铁晶体,则A为Fe,将Fe3+转化为Fe2+.滤液进行水解得到H2TiO3,用硫酸洗去杂化,再煅烧得到TiO2,TiO2、C、Cl2反应得到TiCl4及CO2.
(1)反应①为非氧化还原反应,结合化合价代数和为0计算;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
(3)温度过高水导致TiO2+水解;
(4)氯化过程是TiO2、C、Cl2反应得到TiCl4及CO2;
C与氧气反应降低氧气浓度,C与氧气反应为放热反应,有利于平衡正向移动;
(5)TiCl4极易水解得到TiO2•xH2O,还生成HCl.
解答 解:钛铁矿用氢氧化钠溶液溶解,氧化铝、二氧化硅反应溶解,过滤得到钛铁矿精矿中主要含有FeTiO3、Fe2O3、FeO,再用浓硫酸处理,得到强酸性溶液中含有TiOSO4、Fe2(SO4)3、FeSO4及未反应的硫酸等,加入试剂A后冷却、结晶、过滤得到硫酸亚铁晶体,则A为Fe,将Fe3+转化为Fe2+.滤液进行水解得到H2TiO3,用硫酸洗去杂化,再煅烧得到TiO2,TiO2、C、Cl2反应得到TiCl4及CO2.
(1)反应①为非氧化还原反应,结合化合价代数和为0,可知FeTiO3中钛元素的化合价为+4,由上述分析可知A为Fe,
故答案为:+4;Fe;
(2)氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,相应反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O;SiO2+2OH-═SiO32-+H2O;
(3)温度过高水导致TiOSO4提前水解生成H2TiO3沉淀,Ti元素利用率减小,
故答案为:温度过高水导致TiOSO4提前水解生成H2TiO3沉淀;
(4)氯化过程是TiO2、C、Cl2反应得到TiCl4及CO2,反应方程式为:TiO2+C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$ TiCl4 +CO2,
C与氧气反应减小氧气浓度,使平衡正向移动,C与氧气反应为放热反应,温度升高,使平衡正向移动,促使反应顺利进行,
故答案为:TiO2+C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$ TiCl4 +CO2;C与氧气反应减小氧气浓度,使平衡正向移动,C与氧气反应为放热反应,温度升高,使平衡正向移动,促使反应顺利进行;
(5)TiCl4极易水解得到TiO2•xH2O,还生成HCl,反应方程式为:TiCl4+(x+2)H2O=TiO2•xH2O+4HCl,
故答案为:TiCl4+(x+2)H2O=TiO2•xH2O+4HCl.
点评 本题综合考查物质制备实验,关键是对工艺流程原理的理解,注意分析工艺流程中试剂线、原理线、操作线,要求学生具有一定分析和解决问题的能力,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题

 ,OPA分子中最多有16个原子共平面.
,OPA分子中最多有16个原子共平面.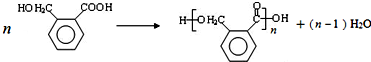 (不必注明反应条件),该反应的类型为缩聚反应.
(不必注明反应条件),该反应的类型为缩聚反应.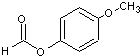 (写出其结构简式).
(写出其结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
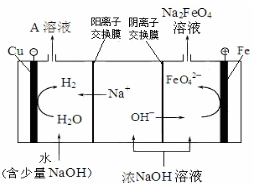
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
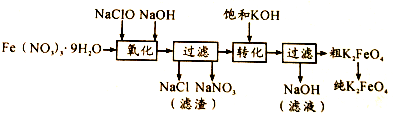
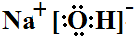 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
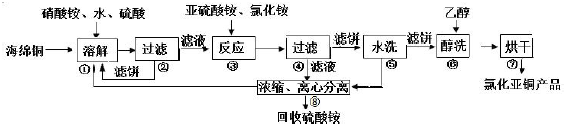
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4Al(SO4)2三种溶液中,c(NH4+由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>cCH3COOH)>c(H+) | |
| C. | 0.1 mol•L-1Na2CO3与0.05mol•L-1 NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1 mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
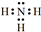 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
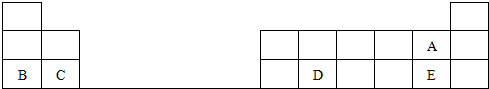
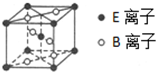 A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E为核电荷数依次增大的五种元素.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态原子3d轨道上有2个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | ① | 420 | ② | 7 | 9 |
| Ⅲ | 探究催化剂对该反应速率的影响 | ③ | 10 | 7 | 9 |
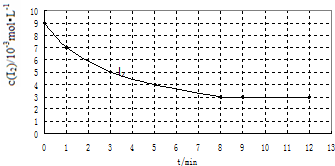
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com