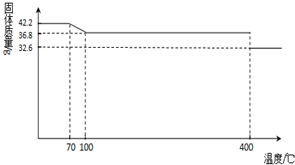
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K
4[Fe(CN)
6]?3H
2O.
42.2g K
4[Fe(CN)
6]?3H
2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示.试回答下列问题:
(1)试确定150℃时固体物质的化学式为
K4[Fe(CN)6]
K4[Fe(CN)6]
.
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为
应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃
应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃
.
(3)在25℃下,将a mol?L
-1的KCN溶液与0.01mol?L
-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
>
>
0.01mol?L
-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数K
a=
(100a-1)×10-7 mol?L-1
(100a-1)×10-7 mol?L-1
.
(4)在Fe
2+、Fe
3+的催化作用下,可实现2SO
2+O
2+2H
2O═2H
2SO
4的转化.已知,含SO
2的废气通入Fe
2+、Fe
3+的溶液时,其中一个反应的离子方程式为4Fe
2++O
2+4H
+═4Fe
3++2H
2O,则另一反应的离子方程式为
2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+
2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+
.则上述转化的重要意义在于
变废为宝,消除污染
变废为宝,消除污染
.
(5)已知Fe(OH)
3的溶度积常数K
sp=1.1×10
-36.室温时在FeCl
3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe
3+是否沉淀完全
c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全
c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全
.(提示:当某离子浓度小于10
-5 mol?L
-1时可以认为该离子沉淀完全了)

 阅读快车系列答案
阅读快车系列答案
 (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O. (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应. (1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应: