
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.7 | 20.12 | 20.00 | 19.88 |
分析 (一)根据溶度积小的沉淀先沉淀;NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;
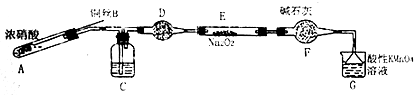
(二)装置A中是浓硝酸和铜加热发生的反应,反应生成二氧化氮和硝酸铜和水,装置C中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮;通过装置D中的干燥剂吸收水蒸气,通过装置F中的干燥剂防止水蒸气进入,通过装置E中的过氧化钠与一氧化氮反应,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气.
(1)可通过上下移动铜丝控制反应是否进行;
(2)浓硝酸和铜加热发生反应生成二氧化氮和硝酸铜和水;装置C中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮;通过装置F中的干燥剂防止水蒸气进入.
(3)①第一次实验数据出现异常,消耗KMnO4溶液体积偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
②该反应中亚硝酸根离子被氧化为硝酸根离子,高锰酸根离子被还原为锰离子;
③根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可求出亚硝酸钠的物质的量,然后求样品中亚硝酸钠的质量分数.
解答 解:(一)Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10,分别向盛有5mL 0.0001mol/L两种盐溶液的试合中同时逐滴滴加0.0001mol/L硝酸银溶液,先生成AgCl沉淀;
故答案为:NaCl;NO2-+H2O?HNO2+OH-;
(二)(1)可通过上下移动铜丝控制反应是否进行,所以使用铜丝的优点是可以控制反应的发生与停止;
故答案为:可以控制反应的发生与停止;
(2)浓硝酸和铜加热发生反应生成二氧化氮和硝酸铜和水,方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;通过装置C中的水与二氧化氮反应生成硝酸和一氧化氮;通过装置F中的干燥剂防止水蒸气进入,与过氧化钠反应;
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;C;防止水蒸气进入;
(3)①a.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(待测)无影响,故a错误;
b.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,造成V(标准)偏大,故b正确;
c.滴定终点时仰视读数,造成V(标准)偏大,故c正确;
故选bc.
②该反应中亚硝酸根离子被氧化为硝酸根离子,高锰酸根离子被还原为锰离子,离子方程式为2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O;
故答案为:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O;
③消耗高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量是0.002mol×$\frac{5}{2}$=0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×$\frac{100mL}{25mL}$=0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数$\frac{1.38g}{2g}$×100%=69.0%;
故答案为:69.0%.
点评 本题考查盐类水解、硝酸的性质、尾气处理、实验条件控制、实验方案设计与评价以及物质含量测定等,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/L KMnO4溶液 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同, 进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 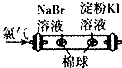 比较Cl2、Br2、I2的氧化性相对强弱 | B. |  探究烧缄溶解时的热效应 | ||
| C. | 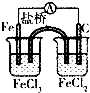 将化学能转化为电能 | D. |  配制一定物质的量浓度的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率理论可指导怎样在一定时间内快出产品 | |
| B. | 化学平衡理论可指导怎样使用有限原料多出产品 | |
| C. | 当反应达到限度时,无论外界条件如何变化,反应体系内各物质含量始终不变 | |
| D. | 正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com