
| A. | 2H2 (g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2 | |
| C. | CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2 | |
| D. | $\frac{1}{2}$ H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2 |
分析 A、生成液态水放出的热量多,放热反应△H<0;
B、气态反应物反应放出的热量多,放热反应△H<0;
C、反应方程式的计量数与反应热成正比;
D、反应方程式的计量数与反应热成正比;
解答 解:A、都为放热反应,△H<0,由于H2O(g)→H2O(l)放热,则前者放出的热量少,则△H1>△H2,故A错误;
B、都为放热反应,△H<0,气态反应物反应放出的热量多,则前者放出的热量多,则△H2>△H1,故B正确;
C、都为放热反应,△H<0,消耗的CO越多,则放出的热量越多,则△H1>△H2,故C错误;
D、都为放热反应,△H<0,消耗的氢气越多,则放出的热量越多,则△H1>△H2,故D错误;
故选B.
点评 本题考查反应热的大小比较,题目难度中等,本题注意从物质反应的程度以及物质的聚集状态的角度比较反应热的大小,本题中含有能正确判断反应的吸放热.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
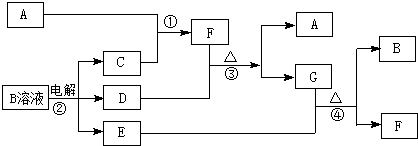
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{118}^{175}$X | B. | ${\;}_{175}^{118}$X | C. | ${\;}_{118}^{293}$X | D. | ${\;}_{293}^{118}$X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
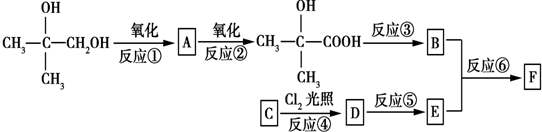
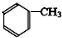 ,反应③的条件是浓硫酸、加热.
,反应③的条件是浓硫酸、加热.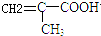 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$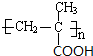 .
.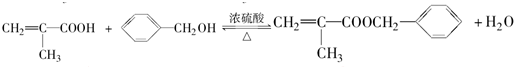 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离汽油和四氯化碳 | 分液 | 四氯化碳和汽油的密度不同 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去乙酸中的乙醚 | 蒸馏 | 乙酸与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com