
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c ( NH4+)>c ( Al3+) | |
| B. | x=10时,溶液中有NH4+、AlO2-、SO42-,且c ( NH4+)>c ( SO42-) | |
| C. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c ( OH-)<c ( AlO2-) | |
| D. | x=30时,溶液中有Ba2+、Al3+、OH-,且c ( OH-)=c ( Ba2+) |
分析 当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,结合铵根离子水解解答;
当x=30时,0.001 mol的NH4Al(SO4)2与0.003 mol Ba(OH)2反应,生成0.002 mol BaSO4、0.001 mol AlO2-、0.001 mol NH3•H2O,且剩余0.001 mol Ba2+和0.001 mol OH-,由于NH3•H2O也是一种碱,存在电离平衡:NH3•H2O?NH4++OH-,据此判断反应中c(OH-)与c(AlO2-)、c(Ba2+)的大小关系.
解答 解:A、当x=10时,NH4Al(SO4)2与Ba(OH)2等物质的量反应,此时OH-量不足,OH-首先与Al3+反应,与NH4+不反应,所以溶液中有未参加反应的NH4+和部分剩余的Al3+存在,同时SO42-也有剩余,但此时不会有AlO2-生成,溶液中c(NH4+)>c(Al3+),故A正确;
B、由A中分析可知,溶液中不会有AlO2-生成,溶液中有NH4+、Al3+、SO42-,参加反应的硫酸根离子为0.001mol,剩余0.001molSO42-,溶液中NH4+未参加反应,但溶液中NH4+水解,故c(NH4+)<c(SO42-),故B错误;
C、当x=30时,0.001 mol的NH4Al(SO4)2与0.003 mol Ba(OH)2反应,生成0.002 mol BaSO4、0.001 mol AlO2-、0.001 mol NH3•H2O,且剩余0.001 mol Ba2+和0.001 mol OH-,由于NH3•H2O也是一种碱,存在电离平衡:NH3•H2O?NH4++OH-,使得溶液中c(OH-)大于0.001 mol,故c(OH-)>c(AlO2-),故C错误;
D、由C中分析可知,溶液中含有Ba2+、AlO2-、OH-,其中溶液中c(OH-)大于0.001 mol,含有0.001 mol Ba2+,c(OH-)>c(Ba2+),故D错误;
故选A.
点评 本题考查离子方程式的有关计算、过量计算等,难度中等,清楚氢氧根离子与铵根离子、铝离子反应的先后顺序是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 钠着火用泡沫火器扑灭 | |
| B. | 苯酚沾在手上,应马上用NaOH溶液洗 | |
| C. | 皮肤上沾有浓硫酸,立即用量水冲洗 | |
| D. | 酒精灯在桌上歪倒失火后,立即用湿布盖上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逐滴滴加盐酸溶液,立即产生气泡,则生成物只含有NaHCO3 | |
| B. | 逐滴滴加盐酸溶液,开始无气泡产生,则生成物可能含有Na2CO3 | |
| C. | 加入BaCl2溶液,有白色沉淀,则可确定CO2和NaOH反应的离子方程式:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 加入MgCl2溶液,有白色沉淀,则反应中NaOH溶液过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青霉素有青霉素F、G、X、K、V | |
| B. | 因碘酒使蛋白质变性,故常用于外用消毒 | |
| C. | 在奶粉中添加三聚氰胺来提高蛋白质的含量 | |
| D. | 氨基酸是至少含有一个氨基和一个羧基的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有分子的数目为0.5NA | |
| B. | 电解精炼铜的过程中转移了NA个电子,则阴极析出32 g铜 | |
| C. | 2.8 g由氮气和一氧化碳组成的混合气体中含有原子的数目为0.1NA | |
| D. | 加热条件下,20mL 10 mol/L 浓硝酸与足量铜反应转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
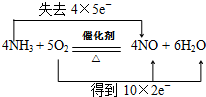
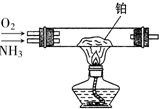
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠、盐酸 | B. | 氢氧化钠、二氧化碳 | ||
| C. | 碳酸氢钠、石灰水 | D. | 过氧化钠、二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com