
 某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:分析 (1)根据先配制溶液然后进行滴定排序;
(2)a、根据热的溶液的体积偏大分析对配制的氢氧化钠溶液的浓度影响;
b、根据会使所称药品的质量小于20.5g判断;
c、根据标准液被稀释,浓度减小,滴定时消耗的标准液体积偏大判断;
d、开始时仰视读数,导致读数偏大;结束时俯视读数,导致读数偏小,最终导致读数偏小;
(3)滴定管的构造及图示读出滴定管的读数i,滴定管是精确量具,0刻度在上;
(4)原溶液无色滴入甲基橙溶液呈黄色,当滴入硫酸,溶液由黄色变为橙色且半分钟颜色不变说明反应达到反应终点;
(5)结合消耗的标准液的体积及浓度计算出氢氧化钠的浓度,再计算出烧碱样品中NaOH的质量分数.
解答 解:(1)在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂,将物质的量浓度为c的标准硫酸溶液装入酸式滴定管.调整液面记下开始读数为V1mL,在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E,
故答案为:C、A、B、D、E;
(2)a、未将溶液冷却至室温就转移到容量瓶中定容,会使所配NaOH溶液的浓度偏大,从而使质量分数偏高,故a错误;
b、砝码放在左盘,NaOH放在右盘,会使所称药品的质量小于20.5 g,会使样品的质量分数偏低,故b正确;
c、酸式滴定管在装入标准H2SO4溶液前未用标准液润洗,会使V(H2SO4)偏大,从而使样品的质量分数偏大,故c错误;
d、开始时仰视读数,结束时俯视读数,会使V(H2SO4)偏小,从而使样品的质量分数偏小,故d正确;
故答案为:bd;
(3)注意读数估读到0.01 mL,滴定管“0”刻度在上,末读数为24.00 mL,初读数为0.25 mL,用量为23.75 mL,
故答案为:23.75;
(4)原溶液无色滴入甲基橙溶液呈黄色,当滴入硫酸,溶液由黄色变为橙色且半分钟颜色不变说明反应达到反应终点,终点时的颜色变化是由黄色变为橙色,
故答案为:由黄色变为橙色;
(5)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×m mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2m(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2m(V2-V1)×10-3mol×$\frac{250}{25}$=2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为:$\frac{80c({V}_{2}-{V}_{1})×1{0}^{-2}g}{mg}$×100%=$\frac{0.8c({V}_{2}-{V}_{1})}{m}$×100%;
故答案为:=$\frac{0.8c({V}_{2}-{V}_{1})}{m}$×100%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,在学习中注意把握相关基本实验方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间t/h | 0 | 5 | 10 | 15 | … | 25 | 30 |
| 总压强p/100kPa | P0 | 1.5P0 | 1.75P0 | 1.875P0 | … | 1.95P0 | 1.95P0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,E中含氧官能团的名称为羟基、碳碳三键.
,E中含氧官能团的名称为羟基、碳碳三键. .
. .
. (任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母).
(任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母). ,其他试剂任选.
,其他试剂任选.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

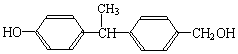 b.
b.
 d.
d.
 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
 .
.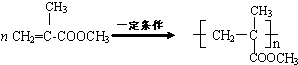 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 很早以前人们用加热胆矾或绿矾的方法制取硫酸 | |
| B. | 将氢气在氯气中燃烧生成氯化氢,然后溶于水得到盐酸,工业上常用此法制取盐酸 | |
| C. | 苏打是焙制糕点所用的发酵粉的主要成分之一,还可以用来治疗胃酸过多的一种药剂 | |
| D. | “水玻璃”是建筑行业中经常使用的一种黏合剂,同时也可用作防腐剂和防火剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com