
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)===FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l)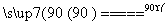 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
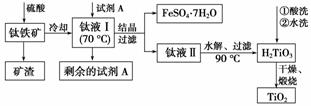
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2收率降低,原因是________________________________________________________________________
________________________________________________________________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
答案 ①Fe 温度过高会导致TiOSO4提前水解,产生H2TiO3沉淀 ②Fe2+ Fe2O3
解析 ①加入H2SO4,除发生FeTiO3酸溶外,还发生反应Fe2O3+6H+===2Fe3++3H2O,为了使Fe3+转化成Fe2+,所以应加入Fe粉(A),钛液中含有FeSO4和TiOSO4,考虑到温度越高,TiOSO4的水解程度越大,造成TiOSO4提前水解生成H2TiO3沉淀,在过滤时,造成钛损失。
②由于Fe2+不可能全部结晶生成绿矾,造成H2TiO3中含Fe2+,滴入H2O2发生反应2Fe2++2H++H2O2===2Fe3++2H2O,所以当加入KSCN后,显红色,由于在H2TiO3中含Fe2+,所以煅烧后会发生反应生成Fe2O3,造成TiO2发黄。


科目:高中化学 来源: 题型:
下列关于物质的组成及分类正确的是( )
A.NH3的水溶液可以导电,说明NH3是电解质
B.明矾、冰水混合物、四氧化三铁都是纯净物
C.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
D.SiO2、NO2、Al2O3都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是 ( )
A.硫酸铝溶液申加入过量氨水 
B.碳酸钠溶液中加入澄清石灰水
C.冷的氢氧化钠溶液中通入氯气
D.稀硫酸中加入铁粉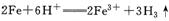
查看答案和解析>>
科目:高中化学 来源: 题型:
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质).请据此回答:
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为 。
(2)装置B所盛的试剂是 ,其作用是 。
(3)装置C所盛试剂是 ,C 中反应的离子方程式是 。
(4)由此得到结论,酸性 : > >
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铜及其化合物的说法中正确的是( )
A.氧化铜可以作氯酸钾分解的催化剂
B.铜器表面的铜绿可以用稀硝酸洗涤
C.硫酸铜溶液与碳酸钠溶液混合会生成氢氧化铜、硫酸钠、二氧化碳
D.铜像用银底垫比用铁底垫好,银不易与空气中的氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
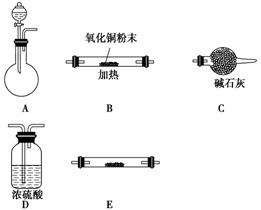
①各仪器的连接顺序为__________,装置E中盛放的试剂为__________,装置C的作用是________________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、Zn粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
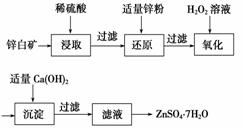
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
①为了提高酸浸效率,可以采取的措施有__________________(写出两条即可)。
②加入适量锌粉的作用为________________。
③氧化过程中H2O2发生反应的离子方程式为______________________________。
④由滤液得到ZnSO4·7H2O的操作依次为__________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列四种溶液:
①1 mol·L-1的盐酸
②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液
④0.001 mol·L-1的NaOH溶液。
四种溶液中,由水电离生成的[H+]之比为____ ____。
____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.元素的单质一定由氧化或还原该元素的化合物制得
B.在化学反应中,得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.含有最高价元素的化合物不一定具有很强的氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com