
| 催化剂 |
| 高温高压 |
| 716.8L |
| 22.4L/mol |
| 催化剂 |
| 高温高压 |
| 4mol |
| 16mol |
| 12mol |
| 24mol |


科目:高中化学 来源:不详 题型:单选题
| A.煅烧粉碎的硫铁矿利于SO2的生成 |
B.对2HI(g)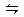 I2(g)+H2(g),增大压强可使平衡体系颜色变深 I2(g)+H2(g),增大压强可使平衡体系颜色变深 |
C.反应NO2+CO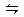 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 CO2+NO;ΔH<0,升高温度可使平衡向逆反应方向移动 |
D.合成NH3反应:N2+3H2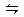 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 2NH3ΔH<0,为提高NH3的产率,理论上应采取降低温度的措施 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
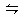 p C(g)+q D(g)的平衡常数为K,下列说法不正确的是 ( )
p C(g)+q D(g)的平衡常数为K,下列说法不正确的是 ( )| A.K越大,达到平衡时,反应进行的程度越大 |
B.K的表达式是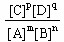 |
| C.K随反应物浓度的改变而改变 |
| D.K随温度的改变而改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
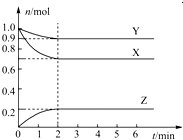
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
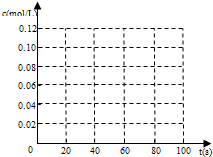
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
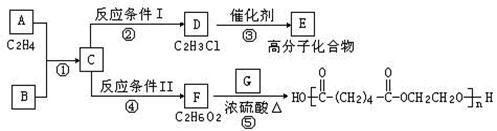
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com