
| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
分析 标况下2.24L混合烃的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,
3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合烃的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此进行解答.
解答 解:标况下2.24L混合烃的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
则1mol混合气体完全燃烧生成1.5mol二氧化碳、2mol水,故混合烃的平均化学式为:C1.5H4,
由于两种气态烃的混合物,则一定含有C原子数小于1.5的烃,所以一定含有甲烷,
又由于甲烷中含4个氢原子,则另一种烃也含有4个氢原子,
根据以上分析可知,混合气体中一定含有甲烷,所以A正确,可能含有乙烯或丙炔,一定没有乙烷,故B、C、D错误,
故选A.
点评 本题考查了有机物分子式的计算,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,明确质量守恒定律在化学计算中的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
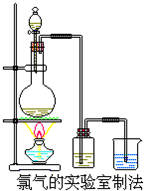 某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
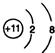 ;
; ;仅由极性键形成的非极性分子的结构式为
;仅由极性键形成的非极性分子的结构式为 ,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.
,该分子中心原子的杂化轨道类型是sp3杂化;简单氢化物的沸点最高的是H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL | B. | 60mL | C. | 80mL | D. | 100mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
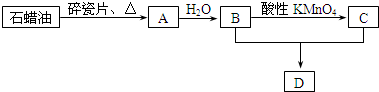
 CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH
CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH  CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;
CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;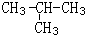 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
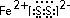 .
.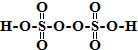
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 1.8mol•L-1•min-1 | D. | 3.6mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
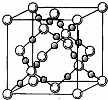 已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题: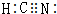
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com