
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,下表为四种金属的熔、沸点:
| Na | Cu | Al | Fe | |
| 熔点(℃) | 97.5 | 1 083 | 660 | 1 535 |
| 沸点(℃) | 883 | 2 595 | 2 200 | 3 000 |
根据以上数据判断其中不能形成合金的是 ( )
A.Cu和Al B.Fe和Cu
C.Fe 和Na D.Al和Na
和Na D.Al和Na
科目:高中化学 来源: 题型:
甲烷和氯气按物质的量比1:1混合,在光照条件下,得到的产物是( )
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.①和③的混合物 C.只有② D.①②③④的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知Co2O3的氧化性>Cl2的氧化性)
从废料中回收氧化钴(CoO)的工艺流程如下:
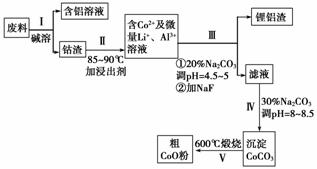
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为____________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钴物质的化学反应方程式为(产物中只有一种酸根)________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:________________________________________________________________________
________________________________________________________________________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:________________________________________
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是________________________________________________________________________。
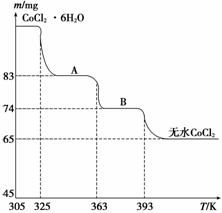
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质A的化学式是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白:
(1)图中标号处需加入的相应物质分别是
①____________、②____________、③____________、
④____________、⑤____________。
(2)写出①处发生反应的离子方程式_________________________________________
________________________________________________________________________;
写出③处发生反应的化学方程式_______________________________ ___________。
___________。
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________________________________________________________________________;
氧化铜________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知AgI为黄色沉淀,AgCl为白色沉淀,25 ℃时,AgI饱和溶液中c(Ag+)=1.22×10-8 mol·L-1,AgCl饱和溶液中c(Ag+)=1.30×10-5 mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是( )
A.溶液中所含溶质的离子浓度大小关系为c(NO )>c(K+)>c(Cl-)>c(I-)>c(Ag+)
)>c(K+)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加KCl溶液、黄色沉淀可能转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.淀粉和蛋白质均可作为生产葡萄糖的原料
C.石油裂化和油脂皂化都是高分子生成小分子的过程
D.装饰材料中的甲醛和芳香烃会造成居室污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com