
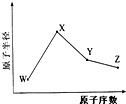
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.分析 由W的一种核素的质量数为18,中子数为10,可知W的质子数为8,是氧元素;X和Ne原子的核外电子数相差1,且根据图可知半径比W大,可知X为11号元素,钠元素;Y的半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是硅元素;Z的电负性在同周期主族元素中最大,且半径也介于X和W之间,所以Z为氯元素,由此分析解答.
解答 解:由W的一种核素的质量数为18,中子数为10,可知W的质子数为8,是氧元素;X和Ne原子的核外电子数相差1,且根据图可知半径比W大,可知X为11号元素,钠元素;Y的半径介于X和W之间,Y的单质是一种常见的半导体材料,所以Y是硅元素;Z的电负性在同周期主族元素中最大,且半径也介于X和W之间,所以Z为氯元素,(1)X和Ne原子的核外电子数相差1,且根据图可知半径比W大,可知X为11号元素,是钠元素,它位于周期表第三周期第ⅠA族;氧的基态原子核外电子排布为:1s22s22p4,所以核外有2个未成对电子,故答案为:三;ⅠA;2;
(2)X、Z形成的化合物是氯化钠和Y、W形成的化合物是二氧化硅,氯化钠是离子晶体而二氧化硅是原子晶体,原子晶体的熔点高于离子晶体,所以二氧化硅的熔点高,故答案为:SiO2;二氧化硅是原子晶体,而氯化钠是离子晶体;
(3)Z的原子半径在同周期主族元素中最小,且半径也介于X和W之间,所以Z为氯元素,与溴元素同主族,稳定性HCl大于HBr,故答案为:HCl;
(4)Y、W形成的化合物是二氧化硅,X的最高价氧化物的水化物是氢氧化钠,反应的离子方程式为;SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;(5)Y与Z形成的化合物为SiCl4,和足量水反应,生成一种弱酸和一种强酸,应生成硅酸与HCl,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3+4HCl.
点评 本题主要考查了元素周期表、核外电子排布、晶体的性质、元素周期律、水解反应等知识,难度不大,解题的关键是元素推断,答题时注意水解原理的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与氢氧化钠反应 | |
| B. | 向氯化铝溶液中加入过量氨水 | |
| C. | 含氟牙膏中加入氯化铝并不断充分搅拌 | |
| D. | 向硫酸铜溶液中通入过量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
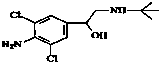 今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )
今年央视“315特别行动”又曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某“瘦肉精”中含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,不正确的是( )| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质可与盐酸反应 | |
| C. | 该物质的核磁共振氢谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和热(△H)的测定中,若使用简易装置时在大小烧杯之间没有垫碎泡沫塑料(或纸条) | |
| B. | 用标准盐酸滴定氢氧化钠溶液,酸式滴定管洗净后,没有用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 食醋总酸含量测定实验中,用移液管移取食醋体积时视线俯视标准线移液 | |
| D. | 在镀锌铁皮的锌镀层厚度的测定中,锌在酸中溶解后没有及时取出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com