
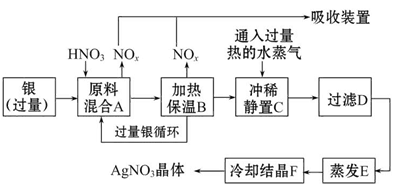


科目:高中化学 来源:不详 题型:实验题
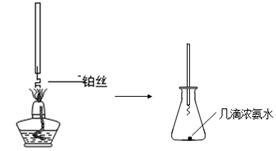
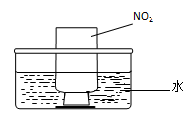
| 可能影响因素 | 实验操作 | 预期现象和结论 |
| 溶液的酸碱性 | 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。 | 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。 |
| 盐的浓度 | | |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶5 | B.1∶4 |
| C.1∶3 | D.任意比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 , CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.(NH4)2SO4 | B.NH4NO3 | C.NH4Cl | D.NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
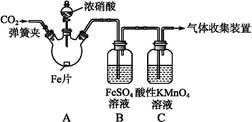
 Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
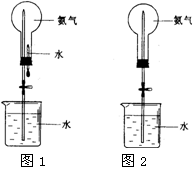
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
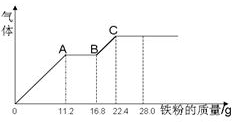
| A.原混合液中NO3-的物质的量为0.4mol |
| B.c(H2SO4)为5mol·L-1 |
| C.溶液中最终溶质为FeSO4 |
| D.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com