
分析 二甲基二氯硅烷[(CH3)2SiCl2]水解得到(CH3)2Si(OH)2和HCl,(CH3)2Si(OH)2发生缩聚反应生成聚硅氧烷,根据反应物和生成物书写方程式.
解答 解:二甲基二氯硅烷[(CH3)2SiCl2]水解得到(CH3)2Si(OH)2和HCl,反应方程式为:(CH3)2SiCl2+2H2O→(CH3)2Si(OH)2+2HCl;
(CH3)2Si(OH)2发生缩聚反应生成聚硅氧烷,反应方程式为n $\stackrel{一定条件下}{→}$(n-1)H2O+
$\stackrel{一定条件下}{→}$(n-1)H2O+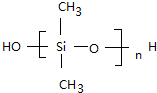 ,
,
答:其水解方程式为(CH3)2SiCl2+2H2O-→(CH3)2Si(OH)2+2HCl;缩聚反应方程式为n $\stackrel{一定条件下}{→}$(n-1)H2O+
$\stackrel{一定条件下}{→}$(n-1)H2O+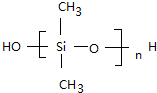 .
.
点评 本题考查化学方程式的书写,为高频考点,涉及缩聚反应、水解反应方程式的书写,明确断键和成键方式是解本题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| D. | Fe3O4俗称铁红,常作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
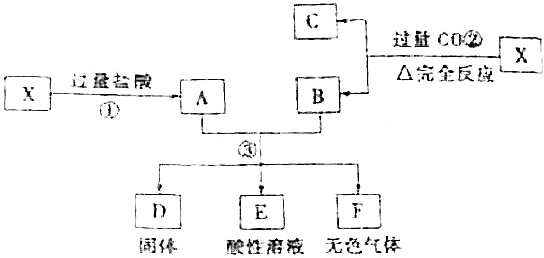
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体甲一定是Na2CO3 | |
| B. | 固体甲一定是NaHCO3 | |
| C. | 当吸收0.15molCO2时,所得固体甲中Na2CO3和NaHCO3物质的量相等 | |
| D. | 在固体甲中加入足量稀盐酸,充分反应后蒸干所得溶液,得到11.7gNaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冒白雾,混合物温度升高 | B. | 产生黄绿色气体 | ||
| C. | 冒白雾,混合物温度降低 | D. | 液体四溅,冒白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其溶沸点就越低 | |
| C. | 卤素各单质都能和水剧烈反应 | |
| D. | 卤素气态氢化物的稳定性越强,还原性也越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
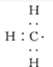 ;
;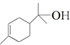 )的官能团的名称为碳碳双键、羟基;
)的官能团的名称为碳碳双键、羟基; 与溴发生加成反应的产物最多有4种,它们的结构简式为
与溴发生加成反应的产物最多有4种,它们的结构简式为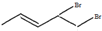 、
、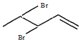 、
、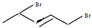 和
和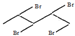 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com