
| A. | 1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量 | |
| C. | S(s)+O2(g)═SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个 S(g) 与1个 O2(g)完全反应可放出 Q kJ的能量 |
分析 A、反应放热,反应物能量高;
B、热化学方程式的化学计量数只表示物质的量;
C、固态硫的能量低于硫蒸汽;
D、热化学方程式的化学计量数表示物质的量.
解答 解:A、△H<0,反应放热,反应物能量高,即1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量高Q kJ,故A错误;
B、热化学方程式的化学计量数表示物质的量,故1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量,故B正确;
C、固态硫的能量低于硫蒸汽,故1mol S(s) 与1mol O2(g)反应生成1mol SO2(g)放出的能量小于Q kJ,故△H>-Q kJ•mol-1,故C错误;
D、热化学方程式的化学计量数表示物质的量,不表示分子个数,故D错误.
故选B.
点评 本题考查对热化学方程式的理解,特别是其化学计量数只表示物质的量.题目难度不大.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NO3-、SO42-、Na+ | B. | Ca2+、H+、Cl-、HCO3- | ||
| C. | NH4+、Al3+、NO3-、OH- | D. | Ba2+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
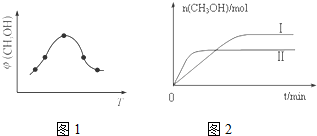
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023 | B. | 6.02×1022 | C. | 6.02×1021 | D. | 6.02×1020 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
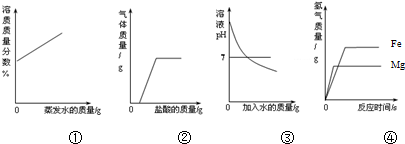
| A. | ①在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| B. | ②向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸 | |
| C. | ③向氢氧化钠溶液中不断加水稀释 | |
| D. | ④相同质量的且过量的镁粉和铁粉,分别与质量和质量分数相同的稀盐酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com