
下列有关物质性质、应用的说法正确的是
A.氯化铝是电解质,可电解其水溶液获得金属铝
B.二氧化硅具有导电性,可用于生产光导纤维
C.SO2具有漂白性,可用于将银耳漂白为“雪耳”
D.小苏打可与酸反应,可用作治疗胃酸过多的药剂
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
①①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是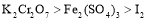
C.反应②中氧化剂与还原剂的物质的量之比为6:1
D.反应③中0.1mol还原剂共失去电子数为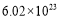
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(12分)工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是 。
(4)置换法除去重金属离子Cd2+,所用物质C为 。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
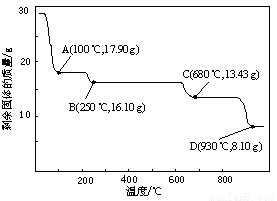
680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX >rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
(14分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
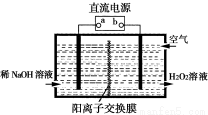
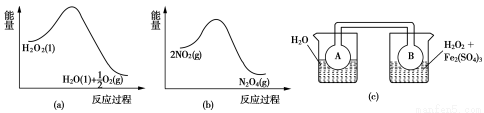
(1)空气阴极法电解制备H2O2的装置如下图所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物。
试回答:
①直流电源的a极名称是 。
②阴极电极反应式为 。
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下制得了H2O2。相对于电解法,该方法具有的优点是安全、 。
(2)Fe3+对H2O2的分解具有催化作用。利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是 。
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜。反应的离子方程式是 ,控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
Cu的平均溶解速率 (×10-3mol·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小
B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱
C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼
D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:填空题
(10分)原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子2p能级上有两个未成对电子;C的基态原子2p能级上的未成对电子数与A原子的相同;C2-与D+具有相同的电子层结构;E和C位于同一主族,F的原子序数为26。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 (用元素符号回答)。
(3)元素A和B的气态氢化物比较, 的沸点特别高。(用化学式填写)
(4)元素A与E所形成晶体属于 晶体
(5)C、D两种元素形成的晶体中阴阳离子的个数比为
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆复旦中学高二上学期期中化学试卷(解析版) 题型:填空题
(11分)在一定温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应。试计算:
(1)O2的转化率为
(2)用SO2表示该反应的反应速率为
(3)平衡时容器内气体压强与反应前的压强之比为 (最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为
(5)平衡常数K的值为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com