
判断正误,正确的划“√”,错误的划“×”
(1)原子的最外层有2个电子的元素一定是ⅡA族元素( )
(2)元素所在的主族序数与最外层电子数之比为1的元素都是金属元素( )
(3)原子及离子的核外电子层数等于该元素所在的周期数( )
(4)原子最外层电子数大于3(小于8)的元素一定是非金属元素( )
(5)某元素的离子的最外层与次外层电子数相同,该元素一定位于第3周期( )
(6)最外层电子数等于或大于3(小于8)的一定是主族元素( )
(7)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素氦( )
(8)最外层电子数比次外层电子数多的元素一定位于第2周期( )
(9)某元素阴离子最外层电子数与次外层相同,该元素位于第3周期;若为阳离子,则位于第4周期( )
(10)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期——“阴上阳下”规律( )
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.在分子中,两个成键的原子间的距离叫做键长
B.H—Cl的键能为431.8 kJ·mol-1,H—I的键能为298.7 kJ·mol-1,这可以说明HCl分子比HI分子稳定
C.含有极性键的分子一定是极性分子
D.键能越大,表示该分子越容易受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
以下微粒含配位键的是 ( )
①N2H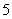 ②CH4 ③OH- ④NH
②CH4 ③OH- ④NH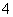 ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_______________________________________________________________。
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为H2+2NiOOH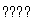 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为_______________________________________________________________。
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH________(填“增大”、“减小”或“不变”),该电极的电极反应式为_______________________________________________________________。
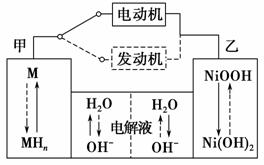
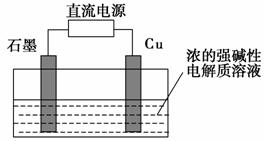
(3)Cu2O是一种半导体材料,可通过如图所示的电解装置制取,电解总反应式为2Cu+H2O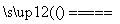 Cu2O+H2↑,阴极的电极反应式是_______________________________________________________________。
Cu2O+H2↑,阴极的电极反应式是_______________________________________________________________。
用镍氢电池作为电源进行电解,当电池中有1 mol H2被消耗时,Cu2O的理论产量为________g。
(4)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的________腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的________(填“正”或“负”)极相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列事实能说明氯元素原子得电子能力比硫元素原子强的是________(填序号)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大 ④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-<S2-
(2)有三种金属元素A、B、C,在相同条件下,B的最高价氧化物的水化物的碱性比A的最高价氧化物的水化物的碱性强;若将A、C相连后投入稀硫酸中,发现C表面有明显气泡产生。则这三种金属元素的原子失电子能力由强到弱的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________________,写出一种工业制备单质F的离子方程式________________________________________________________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为________________________;
在产物中加入少量KI,反应后加入CCl4并振荡,有机层显________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于取代反应的是 ( )。
①CH3CH===CH2+Br2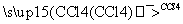 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH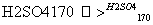 CH2===CH2↑+H2O
CH2===CH2↑+H2O
③CH3COOH+CH3CH2OH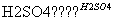 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3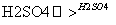 C6H5NO2+H2O
C6H5NO2+H2O
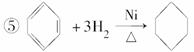
⑥2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
⑦纤维素最终水解生成葡萄糖
⑧油脂的皂化反应
⑨氨基酸生成多肽的反应
⑩nCH2===CH2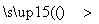 CH2—CH2
CH2—CH2
A.③④⑦⑧ B.①②③④
C.⑤⑥⑦⑧ D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操 作 | 现 象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是________。
(3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是________。
②由实验a、b不能判断白雾中含有HCl,理由是____________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com