
一定温度下,在三个体积均为1.0 L 的恒容密闭容器中发生反应:
2CH3OHg)CH3OCH3g)+H2Og)
| 容器 编号 | 温度℃) | 起始物质的量mol) | 平衡物质的量mol) | |
| CH3OHg) | CH3OCH3g) | H2Og) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是双选) )。
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
解析 对比容器Ⅰ、Ⅲ,可知起始时物质的量都是0.20 mol,容器Ⅲ温度降低,CH3OCH3平衡时的物质的量增大,说明平衡正向移动,故正反应是放热反应,A项正确;B项,容器Ⅱ的投料量是容器Ⅰ的两倍,相当于加压,但题给反应是气体体积相等的反应,两者建立等效平衡,CH3OH体积分数不变,错误;C项,容器Ⅰ的温度比容器Ⅲ高,温度高,化学反应速率快,到达平衡时间短,错误;D项,容器Ⅰ中,
2CH3OHCH3OCH3+H2O
c始)/mol·L-1) 0.20 0 0
c转)/mol·L-1) 0.16 0.08 0.08
c平)/mol·L-1) 0.04 0.08 0.08
K=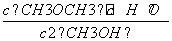 =4,
=4,
Qc=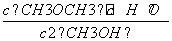 =
=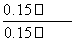 =
=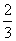 <K,
<K,
则反应将向正反应方向进行,正确。
答案 AD


科目:高中化学 来源: 题型:
下列推断正确的是( )
| 选项 | 事实 | 结论 |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 可用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | 氧化铜高温下生成红色物质,该物质可与稀硫酸反应 | 氧化铜高温下可分解生成Cu2O |
| D | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒压密闭容器M(如图Ⅰ) 和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?) + B(?) xC(g) ΔH<0
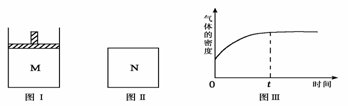 平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是( )
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是( )
A. x =4
B. 若N中气体的密度如图Ⅲ所示,则A、B一定都是气态
C. 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
分别向1 L 0.5 mol·L-1的BaOH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是 )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在一固定体积的密闭容器中,可逆反应As)+3Bg)2Cg)达到平衡时,下列说法正确的是 )。
①C的生成速率和C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥混合气体的平均相对分子质量不变
A.②④⑤ B.①③④⑥
C.①②④⑥ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物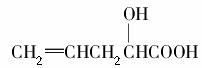 在不同条件下至少可能发生7种不同类型的反应:
在不同条件下至少可能发生7种不同类型的反应:
①取代 ②加成 ③消去 ④氧化 ⑤酯化 ⑥加聚 ⑦缩聚,其中由于分子结构中含有“—OH”而可能发生的反应是( )。
A.②④⑥⑦ B.①③⑤⑥
C.②③④⑤ D.①③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na;而与金属钠反应时生成C5H8O3Na2。则该有机物的同分异构体的种类(不考虑立体异构)有
A.10种 B.11种 C.12种 D.13种
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内最多,是一种常用的食品添加剂。该化合物具有如下性质:
(ⅰ)在25 ℃时,电离平衡常数K1=3.9×10-4,K2=5.5×10-6
(ⅱ)A+RCOOH(或ROH)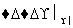 有香味的产物
有香味的产物
(ⅲ)1 mol A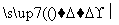 慢慢产生1.5 mol气体
慢慢产生1.5 mol气体
(ⅳ)核磁共振氢谱表明A分子中有5种不同化学环境的氢原子。
与A相关的反应框图如下:
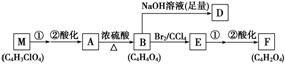
(1)根据化合物A的性质,对A的结构可作出的判断是
________________________________________________________________________(填序号)。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有羟基 d.有—COOR官能团
(2)写出A、F的结构简式:
A:________________________________________________________________________;
F:________________________________________________________________________。
(3)写出下列反应类型:A—→B____________;B—→E____________。
(4)写出下列反应的反应条件:
E—→F第①步反应___________________________________________________________。
(5)在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢。写出该反应的化学方程式:____________________________________________________。
(6)写出与A具有相同官能团的A的同分异构体的结构简式:_________________________
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种短周期元素,原子序数依次增大,三种元素原子序数之和为35,A、C同主族,B+核外有10个电子,回答下列问题:
(1)B元素是______________(填元素符号)。
(2)A、B、C中任意两种元素之间可形成多种化合物,其中属于离子化合物的化学式分别为________、________、________。B和C两元素组成的化合物的水溶液显 (酸、碱、中)性。
(3)写出基态A原子的电子排布式:A________。画出基态C原子的价电子的电子排布图(轨道表示式) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com