
| A. | C3H7Cl | B. | C3H6 | C. | CF2Cl2 | D. | C4H6 |
分析 A.先写出C3H8的结构简式,根据一氯代物的种类等于氢原子的种类,利用等效氢解答;
B.根据分子式可知,该物质可能为烯烃或环烷烃,据此写出同分异构体.
C.二氟甲烷是甲烷四个氢原子中的两个被氯原子代替的产物,甲烷中的四个氢原子是完全等效的;
D.根据分子式可知,该物质可能为炔烃或二烯烃或环烷烃等,据此写出同分异构体.
解答 解:A.C3H8只有一种结构:CH3CH2CH3,分子中只有2种氢原子,所以C3H7Cl的同分异构体有2种,故A不符合;
B.C3H6可以为烯烃,也可以为环烷烃,C3H6的同分异构体有2种:CH2═CH-CH3、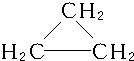 ,故B不符合;
,故B不符合;
C.甲烷是正四面体结构,其分子中的四个氢原子是完全等效的,即甲烷的二氟代物只有一种,故C符合;
D.C4H6可以为炔烃或二烯烃或环烷烃,C4H6的同分异构体有5种:CH3C≡CCH3、CH≡CCH2CH3、CH2=CH-CH=CH2、环丁烷、甲基环丙烷,故D不符合;
故选C.
点评 本题考查同分异构体的求算,题目难度中等,注意把握掌握同分异构体的判断方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
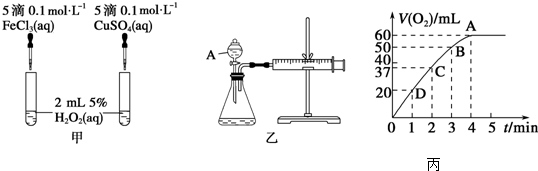
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol任何气体都含有相同的原子数 | |
| B. | 在100℃、1×104Pa时,1mol O2中约含有6.02×1023个O2分子 | |
| C. | 含有阿伏加德罗常数个水分子的水(4℃)其体积为18mL(ρ=1g/cm3) | |
| D. | 两种物质完全反应时,它们的物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S气体能用浓硫酸进行干燥(浓硫酸的吸水性) | |
| B. | 铜与浓硝酸制备NO2气体(浓硝酸的强氧化性、酸性) | |
| C. | SO2的水溶液能够使品红溶液褪色(H2SO3的强氧化性) | |
| D. | 可口可乐瓶盖打开后,有大量气体逸出(H2CO3的挥发性) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁强化酱油可通过膳食补充人体所需的铁元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速度 vA=2mol/(L•min)逆反应速度vB=2 mol/(L•min) | |
| B. | 正反应速度 vA=2mol/(L•min)逆反应速度vC=2 mol/(L•min) | |
| C. | 正反应速度 vA=1mol/(L•min)逆反应速度vB=1.5 mol/(L•min) | |
| D. | 正反应速度 vA=1mol/(L•min)逆反应速度vC=1.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
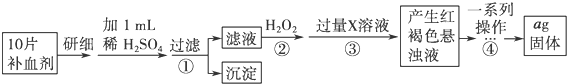
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com