

| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 已知图Ⅱ△H<0,由图Ⅱ知,t3时采取的措施是降低反应体系温度 | |
| C. | 由图Ⅱ知,反应在t6时,NH3体积分数最大 | |
| D. | Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出5.16kJ的热量 |
分析 A.反应物和生成物的体积分数相同时,反应不一定达到平衡状态,升高温度平衡向吸热反应方向移动;
B.降低温度平衡向吸热反应方向移动;
C.t1时刻正逆反应速率相等,反应达到平衡状态;t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度;
D.根据反应热与反应物物质的量之间的关系式计算.
解答 解:A.由图Ⅰ知,反应在T1、T3处反应物和生成物的体积分数相对但反应不一定达到平衡,T2-T3升高温度,反应物体积分数增大,生成物体积分数减小,平衡向逆反应方向移动,所以正反应是放热反应,△H<0,故A错误;
B.由图Ⅱ知,t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,故B错误;
C.由图Ⅱ知,t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂,平衡不移动;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,平衡向逆反应方向移动;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度,平衡向逆反应方向移动,所以反应在t1时,NH3体积分数最大,故C正确;
D.该反应是一个放热反应,1molCO完全转化时放出43KJ能量,当转化(0.30-0.18)mol/L×10L=1.2molCO时放出51.6kJ的热量,故D错误;
故选C.
点评 本题考查了图象分析题,难度较大,分析时注意起点、拐点、转折点等特殊点,然后联系教材中的理论知识,方可做出正确判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用Cu作阴、阳电极,电解CuCl2溶液 | |
| B. | 用Cu作阴、阳电极,电解K2SO4溶液 | |
| C. | 铜锌合金在潮湿空气中发生电化学腐蚀 | |
| D. | Cu作原电池的负极,碳棒作正极,NaCl溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸 | |
| C. | 漂白粉、福尔马林、冰水、王水、氯水均为混合物 | |
| D. | Na2O、NaOH、Na2CO3、NaCl都属于钠的含氧化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
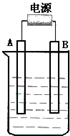 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com