
计算或判断下列电解质溶液中的粒子数目
(1)含0.4 mol Al2(SO4)3的溶液中,含________mol SO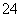 ,Al3+的物质的量________
,Al3+的物质的量________
0.8 mol(填“>”、“<”或“=”)。
(2)1 L 0.1 mol·L-1的CH3COOH溶液中,n(CH3COOH)________ 0.1 mol,
n(CH3COO-)________ 0.1 mol,n(H2O)________ 0.1 mol(填“大于”、“小于”或“等 于”)。
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)检验NH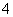 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 ( )
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 ( )
(2013·福建理综,10D)
(2)液氨汽化时要吸收大量的热,可用作制冷剂 ( )
(2013·江苏,4A)
(3)可用浓盐酸检验氨气,反应为NH3+HCl===NH4Cl ( )
(2013·北京理综,8A改编)
(4)实验室用NH4Cl和Ca(OH)2制备NH3涉及氧化还原反应 ( )
(2012·广东理综,10D)
(5)过量的铜与浓硝酸反应有一氧化氮生成 ( )
(2012·重庆理综,7C)
(6)将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
( )
(2012·山东理综,12D)
(7)向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体,是因为HNO3分解生成了NO2  ( )
( )
(2011·四川理综,11A)
(8)用浓HNO3与Cu反应制备NO2 ( )
(2012·广东理综,9C)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列有关说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.废旧电池应集中回收,并填埋处理
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E、F、G、H可以发生如图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
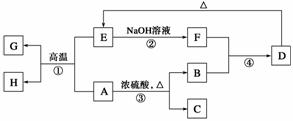
请填空:
(1)H的名称是__________。
(2)E的两种用途是__________、__________。
(3)反应③的化学方程式是_______________________________________________。 (4)反应④的离子方程式是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
富马酸亚铁(分子式为C4H2O4Fe,结构简式为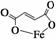 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。
(1)下图为实验室模拟工业制取富马酸亚铁的流程图:
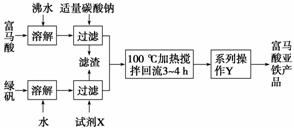
①根据题意,请你写出富马酸的结构简式:___________________________________。
②绿矾(FeSO4·7H2O)在保存过程中形成的杂质主要有________(填化学式)。
③操作Y包括________、冷却结晶、过滤、洗涤、干燥等。
④判断操作Y中“洗涤”富马酸亚铁产品已洗净的实验方法是________________________________________________________________________。
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有KSCN溶液、酸性KMnO4溶液、稀硫酸。已知SCN-能被MnO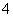 氧化)。填写下表相应空格:
氧化)。填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。
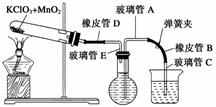
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置放置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口,一直要在烧杯的水中,不能离开水面,其理由是_________________________________________________________________
________________________________________________________________________。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?________________________________________________________________________
________________________________________________________________________。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为________L;混合物中MnO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H12O2的二元醇有多种同分异构体,其中主链上碳原子数为3的同分异构体数目为m,主链上碳原子数为4的同分异构体数目为n。下列各组数据中m和n均正确的选项是(不包括同一个碳原子上连接两个羟基的化合物)
| A.m=1,n=6 | B.m=2,n=6 | C.m=1,n=7 | D.m=2,n=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com