
| A. | 原子数 | B. | 密度 | C. | 质子数 | D. | 质量 |
分析 同温同压下,气体摩尔体积相等,体积相等的气体的物质的量一定相等,根据ρ=$\frac{M}{{V}_{m}}$、m=nM、N=nNA结合分子构成进行计算和判断.
解答 解:同温同压下,气体摩尔体积相等,体积相等的气体,其物质的量相等,
A.N=nNA知,分子数之比等于物质的量之比,物质的量相等,所以其分子数相等,每个分子中原子个数相等,所以其原子数相等,故A正确;
B.根据ρ=$\frac{M}{{V}_{m}}$可知,相同条件下其密度之比等于摩尔质量之比,二者摩尔质量不一定相等,所以其密度不一定相等,故B错误;
C.根据A知,其分子总数相等,每个分子中质子总数不相等,所以其质子总数不一定相等,故C错误;
D.根据m=nM知,物质的量相等时其质量之比等于摩尔质量之比,二者摩尔质量不一定相等,所以其质量不一定相等,故D错误;
故选A.
点评 本题考查阿伏伽德罗定律及其推论,题目难度中等,明确物质的量公式中各个物理量的关系是解本题关键,注意气体摩尔体积的适用范围及适用条件.


科目:高中化学 来源: 题型:解答题
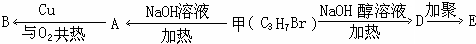
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热至较高温度,水的离子积变大,pH减小,呈酸性 | |
| B. | 碱性氢氧燃料电池工作时,OH-向正极迁移 | |
| C. | 反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H>0 | |
| D. | 用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂和蛋白质都是高分子化合物 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,但二者分子中官能团不同 | |
| D. | 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,转移8mol e- | |
| D. | 该反应中H2O是反应物之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com