
| A. | 生铁属于合金 | |
| B. | 金属的冶炼过程通常是把金属阳离子还原成单质的过程 | |
| C. | 回收废旧金属既可以治理污染,又可以缓解资源短缺 | |
| D. | 工业上电解氧化镁获得金属镁 |
分析 A.合金是指在一种金属中加热融合其他金属或非金属形成的混合物;
B.金属的冶炼就是指将化合态的金属转变为游离态的金属,也就是将化合物中的金属转变为金属单质;
C.根据回收利用废旧金属的意义进行分析判断;
D.氧化镁熔点很高,工业上电解熔融氯化镁获得金属镁;
解答 解:A.生铁中含有铁与碳,属于合金,故A正确;
B.金属冶炼就是将化合物中的金属转变为金属单质,即把金属阳离子还原成单质的过程,故B正确;
C.回收利用废旧金属不仅可以节约资源,而且可以减少对环境的污染,故C正确;
D.因为MgO的熔点高于MgCl2,因此电解熔融MgCl2更经济,工业上电解氯化镁获得金属镁,故D错误;
故选:D.
点评 本题考查了合金的概念、金属的冶炼等,熟悉概念及金属活泼性与冶炼方法的选择是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | AlN的摩尔质量为41 g | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | 上述反应中,每生成1 mol AlN需转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷 | B. | CHCl3 | C. | 苯酚 | D. | 酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前应先检查它是否漏水 | |
| B. | 容量瓶先用蒸馏水洗净,再用待配液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2 cm处,再改用胶头滴管滴加蒸馏水至刻度线 | |
| D. | 浓硫酸稀释后马上转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 a mol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 其他条件不变向上述平衡体系中再充入lmolX,v(正)增大,v(逆)减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

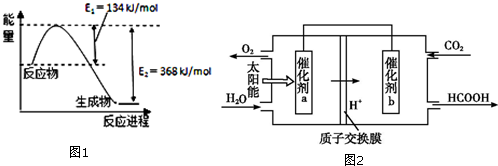
| 化学式 | HCOOH | H2CO3 | HCIO |
| 电离平衡常数 | 1.77×10-4 | Ki1=4.3×10-7 Ki2=5.6×10-11 | 3.0×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com