
| A. | 钢化玻璃 | B. | 氮化硅陶瓷 | C. | 光导纤维 | D. | 陶瓷 |
分析 传统的无机非金属材料:如水泥、耐火材料、平板玻璃、仪器玻璃和普通的光学玻璃以及日用陶瓷、卫生陶瓷、建筑陶瓷、化工陶瓷和电瓷、搪瓷、磨料(碳化硅、氧化铝)、铸石、碳素材料、非金属矿(石棉、云母、大理石等).
新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等.
解答 解:A.钢化玻璃与普通玻璃的成分相同,是传统无机非金属材料,故A错误;
B.氮化硅陶瓷是新型无机非金属材料,故B正确;
C.光导纤维是新型无机非金属材料,故C正确;
D.陶瓷是传统无机非金属材料,故D错误.
故选BC.
点评 本题主要考查生活中常见的几种材料,难度不大,熟悉材料中的成分,能运用所学化学知识来解决实际问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
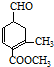 )、乙(
)、乙(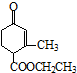 )两种有机物,下列说法中不正确的是( )
)两种有机物,下列说法中不正确的是( )| A. | 可用新制的氢氧化铜悬浊液区分这两种有机物 | |
| B. | 1 mol甲与H2在一定条件下反应,最多消耗3 mol H2 | |
| C. | 甲、乙互为同分异构体 | |
| D. | 等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
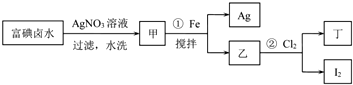
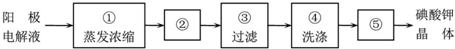
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基-1-丁烯 | D. | 2,3-二甲基-1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
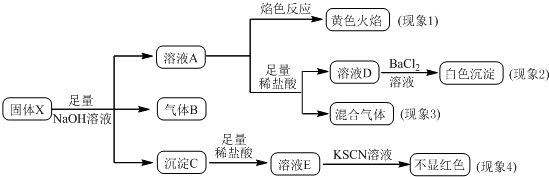
| A. | 根据现象1可推出该固体粉末中一定含有NaNO3 | |
| B. | 根据现象2可推出该固体粉末中一定含有K2SO4 | |
| C. | 根据现象3可推出该固体粉末中一定含有K2SO3 | |
| D. | 根据现象4可推出该固体粉末中一定没有Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V=0时:[H+]>[Cl-]=[CH3COOH] | B. | V=10 mL时:[OH-]+[CH3COO-]=[H+] | ||
| C. | V=20 mL时:[Na+]=[CH3COO-]+[Cl-] | D. | 加入NaOH溶液至pH=7时,V>20 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com