
甲醇(CH3OH)燃料电池可用作电动汽车电源,下图为电池示意图。在电池的一极通入甲醇,另一极通入氧气,工作时H+由负极移向正极。下列叙述不正确的是
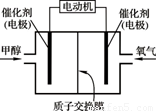
A.外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g
B.通甲醇一端为负极
C.正极反应为:O2+4H++4e- = 2H2O
D.负极反应为:CH3OH+H2O+6e- = CO2↑+6H+
D
【解析】
试题分析:甲醇在反应中失去电子,因此甲醇在负极通入,电极反应式为CH3OH+H2O -6e- = CO2↑+6H+。正极通入氧气,电极反应式为3O2+12H++12e-=6H2O,所以总反应式为2CH3OH+3O2=2CO2+4H2O。A、外电路通过0.6 mol电子时,理论上消耗甲醇的物质的量是0.1mol,其质量=0.1mol×32g/mol=3.2 g,A正确;B、燃料电池中,通甲醇一极为负极,故B正确;C、燃料电池正极上是氧气发生得电子的还原反应,在酸性电解质下,正极电极反应式为:3O2+12H++12e-=6H2O,故C正确;C、电池工作时电子从负极甲醇一极流向正极氧气一极,所以负极电极反应式为为CH3OH+H2O-6e- = CO2↑+6H+,D不正确,答案选D。
考点:考查甲醇燃料电池的有关判断


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇(CH3OH)燃料电池被认为是很有应用前景的燃料电池.下图是自呼吸式甲醇燃料电池工作示意图.电池总反应:2CH3OH+3O2=2CO2+4H2O,则图中进入c口的物质是( )
甲醇(CH3OH)燃料电池被认为是很有应用前景的燃料电池.下图是自呼吸式甲醇燃料电池工作示意图.电池总反应:2CH3OH+3O2=2CO2+4H2O,则图中进入c口的物质是( )查看答案和解析>>
科目:高中化学 来源: 题型:
(08广州综合测试,17)甲醇(CH3OH)燃料电池可用于笔记本电脑、汽车等,一极通入甲醇,另一极通入氧气,电池工作时,H+由负极移向正极。下列叙述正确的是( )
A.氧气为负极
B.甲醇为负极
C.正极反应为:O2+4H++4e-== 2H2O
D.负极反应为:CH3OH+H2O+6e- == CO2↑+ 6H+
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
某种甲醇(CH3OH)燃料电池示意图如下,其中电解质是稀酸溶液。下列叙述错误的是
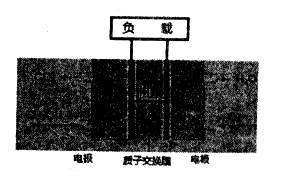
A. 电池反应中甲醇被氧化
B. 质子交换膜的作用相当于盐桥
C. 产生电能时,负极附近溶液的pH暂时升高
D. 负极反应式是:CH3OH-6e-+H2O=CO2+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com