
【题目】锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO42-(绿色)、MnO4-(紫色)形式存在。MnO2不溶于稀硫酸。
(1)将8 mL 0.1 mol·L-1的酸性高锰酸钾溶液和2 mL l.0mol/L的草酸(H2C2O4)溶液在试管中混合,然后将试管置于25℃水浴中,KMnO4溶液浓度随时间变化关系如下图所示。

① 写出发生反应的离子方程式:____________
② 计算前40秒用草酸表示的平均反应速率v(草酸)=________________.
③ 40s-65s的反应速率比前40s快,解释原因___________
(2)已知反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。
① 向MnO4-溶液中加入足量稀硫酸,可观察到的现象是__________.
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时K2MnO4的转化率为4/9,则该反应的平衡常数的值为__________
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,则该反应的△H___0(填“大于” “小于”或“等于”)。
(3)碳酸锰是一种重要的工业原料。工业生产中常用复分解法生产MnCO3:
MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4. 溶液的pH不能过低也不能过高,原因是_______。设MnSO4溶液为0.19mol/L,则溶液的pH 最高不能超过_________。
[己知MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13]
(4)制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中“![]() ”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。

【答案】 5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O 1×10-3mol·L-1·s-1 Mn2+是此反应的催化剂,随着反应的进行,开始生成Mn2+,且浓度越来越大 溶液由绿色变为紫色,并有黑色固体生成 l 小于 pH过低沉淀量少;pH过高MnCO3会生成Mn(OH)2 8.0 Mn2++2e-=Mn、2H++2e-=H2↑
【解析】(1)① 高锰酸钾与草酸发生氧化还原反应,生成锰离子、二氧化碳和水,反应的离子方程式为5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O,故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;
② 前40秒KMnO4溶液的浓度变化了0.016mol/L,则草酸的浓度变化为1.6mol/L×![]() =0.04mol/L, v(草酸)=
=0.04mol/L, v(草酸)= ![]() =1×10-3mol·L-1·s-1,故答案为:1×10-3mol·L-1·s-1;
=1×10-3mol·L-1·s-1,故答案为:1×10-3mol·L-1·s-1;
③ 40s-65s的反应速率比前40s快,可能的原因是Mn2+是此反应的催化剂,随着反应的进行,开始生成Mn2+,且浓度越来越大,故答案为:Mn2+是此反应的催化剂,随着反应的进行,开始生成Mn2+,且浓度越来越大;
(2) ① 根据反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-,向MnO4-溶液中加入足量稀硫酸,氢氧根离子浓度减小,平衡正向移动,溶液由绿色变为紫色,并有黑色固体生成,故答案为:溶液由绿色变为紫色,并有黑色固体生成;
MnO2+2MnO4-+4OH-,向MnO4-溶液中加入足量稀硫酸,氢氧根离子浓度减小,平衡正向移动,溶液由绿色变为紫色,并有黑色固体生成,故答案为:溶液由绿色变为紫色,并有黑色固体生成;
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时,c(OH-)=1 mol/L K2MnO4的转化率为4/9,平衡时K2MnO4的浓度为0.512 mol/L×(1-![]() ),KMnO4的浓度为0.512 mol/L×
),KMnO4的浓度为0.512 mol/L×![]() ×
×![]() =0.512 mol/L×
=0.512 mol/L×![]() ,则该反应的平衡常数的值为
,则该反应的平衡常数的值为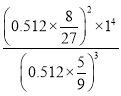 =1,故答案为:1;
=1,故答案为:1;
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,说明降低温度,平衡正向移动,则该反应的△H<0,故答案为:小于;
(3)加入稍过量的NH4HCO3能提高MnSO4的装化率,使MnCO3沉淀完全,溶液的pH不能过低,否则H+可与MnCO3,NH4HCO3反应,溶液的pH也不能过高,pH过高MnCO3会生成Mn(OH)2沉淀,故答案为:使MnCO3沉淀完全;MnCO3沉淀量少,NH4HCO3与酸反应(或MnCO3、NH4HCO3与酸反应溶解);根据MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13。Mn(OH)2开始沉淀的c(OH-)=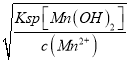 =
=![]() =10-6 mol/L,pH=8,因此使MnCO3沉淀完全,而且不生成Mn(OH)2,溶液的pH 最高不能超过8,故答案为:pHspan>过低沉淀量少;pH过高MnCO3会生成Mn(OH)2 ; 8.0。
=10-6 mol/L,pH=8,因此使MnCO3沉淀完全,而且不生成Mn(OH)2,溶液的pH 最高不能超过8,故答案为:pHspan>过低沉淀量少;pH过高MnCO3会生成Mn(OH)2 ; 8.0。
(4)电解池工作时,阴离子向阳极移动,阳离子向阴极移动,由阴离子移动方向可知石墨为阳极,铂极为阴极,阴极发生还原反应,生成锰的同时,氢离子得到电子被还原生成氢气,铂电极的电极反应式为Mn2++2e-=Mn、2H++2e-=H2↑,故答案为:Mn2++2e-=Mn、2H++2e-=H2↑。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】按要求填空
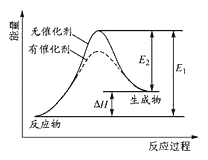
(1)某反应的反应过程中能量变化如图所示,回答下列问题:
E逆反应的活化能___E反应的活化能(填“大于”或“小于”)
(2)50mL 0.50mol/L盐酸与50mL 0.55mo/L NaOH溶夜在如图所示的装置中进行中和反应,逋过测定反应过程中所放出的热量可计算中和热,回答下列问题:
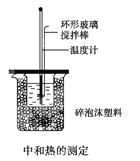
①烧杯间填满碎泡沫塑料作用是________
②实验中改用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等“或“不相等”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
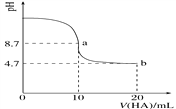
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物说法,不正确的是( )
A.氮气性质稳定,可用于工业制镁的冷却剂
B.N2H4和N2O4可用作航天飞机的燃料
C.碳酸氢铵常用作氮肥,不可与碱性肥料混用
D.硝酸可用于制造染料、塑料、炸药和硝酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g) ![]() N2O4(g)(正反应为放热反应)。现将一定
N2O4(g)(正反应为放热反应)。现将一定
量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:

(1)图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min);反应进行至25 min时,曲线发生变化的原因是________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( ) ![]()
A.原子半径:Z>W>X>Y
B.元素X、Y、Z、W的最高化合价分别与其主族序数相等
C.最简单气态氢化物的热稳定性:H2Y>XH3>WH3>ZH4
D.最高价氧化物对应水化物的酸性:HXO3>H3WO4>H2ZO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( ) 
A.湿润淀粉碘化钾试纸未变蓝说明硫元素的非金属性强于碘元素
B.沾有KMnO4溶液的滤纸褪色证明了SO2具有漂白性
C.实验后,可把注射器中的物质缓缓推入NaOH溶液中,以减少环境污染
D.蓝色石蕊试纸变红说明SO2溶于水显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等.
(1)用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示: 
稀硫酸、铜和氧化铁反应过程中属于氧化还原反应的离子方程式是;向混合溶液中通入热空气的反应的离子方程式是;由滤液得到无水硫酸铜的实验操作是 .
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵.主要的工艺流程如下图所示: 
①吸收塔中发生反应的化学方程式是 .
②有数据表明,吸收塔中溶液的pH在5.5﹣6.0之间,生产效率较高.当控制一定流量的尾气时,调节溶液的pH的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时VA=VB= a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0 ,达到平衡Ⅰ时VB = 0.9a升,试回答:

(1)A中W和B中Z的物质的量: n(W)A_______ n(Z)B (填<、>、或=)
(2)B中X 的转化率α(X)是_____________
(3)打开K,过一段时间重新达平衡Ⅱ时,B的体积为_____________-升?(用含a的代数式表示,连通管中气体体积不计)[写出(2)、(3)的计算过程]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com