
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析:
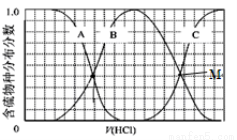
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
(14分,每空2分))
I.(1)AD (2)P/P0 79.82%(或0.80)
II.(1)xCOS(g) = xCO(g)+ Sx(s) ΔH=0.5(bx-ax)kJ/mol
(2)①HS- c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
②M:2S2-+3H+=HS-+H2S
【解析】
试题分析:I.(1)因为该反应中有固体参与,所以气体的质量一直变化,而容器的体积不变,所以当混合气体的密度不再发生改变时,证明已达平衡状态,正确;B、消耗1 mol H2O(g)的同时生成1 mol H2
都是正反应方向,不能证明反应达平衡状态,错误;C、反应方程式固定,则反应的ΔH固定,所以不能判断化学平衡状态是否到达,错误;D、CO和H2的物质的量之比是1:1,所以v正(CO) = v逆(H2)时符合正逆反应速率相等,说明反应达平衡状态,正确,答案选AD;
(2)开始时气体的物质的量为1mol,根据恒温恒容条件下,气体的物质的量之比等于气体的压强之比得n总=P/P0mol,由表中数据可知平衡时的压强为8.20(100Kpa),开始的压强为4.56(100Kpa),设消耗水蒸气的物质的量为xmol,则平衡时H2O(g)、CO(g)、H2(g)的物质的量(mol)分别为1-x、x、x,根据n总=P/P0mol,得1-x+x+x=8.20/4.56,解得x=0.7982,所以反应物H2O(g)的转化率α =79.82%;
II.(1)根据盖斯定律得目标方程式=(②-①)/2,所以所求热化学方程式为xCOS(g) = xCO(g)+ Sx(s) ΔH=0.5(bx-ax)kJ/mol;
(2)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,盐酸先与氢氧化钠反应生成氯化钠和水,再与硫化钠反应生成硫氢化钠,此时溶液中S2?的含量逐渐减小,HS?的含量逐渐增大,继续滴加盐酸,则HS?与氢离子结合生成硫化氢,则溶液中H2S的含量逐渐增大,HS?的含量逐渐减小,所以A、B、C分别代表S2? 、HS?、H2S的分数变化。B曲线代表、HS?的分数变化;根据物料守恒,Na元素的浓度是S元素浓度的3倍,可得滴加过程中,溶液中一定成立的是c(Na+)=3[c(H2S)+c(HS-)+c(S2-)];滴加的过程中溶液中始终存在Na+ 、Cl-、HS-、S2-、OH-、H+,根据电荷守恒可得c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
②M点表示HS-与S2-分数相等,所以溶液中发生的总的离子方程式为2S2-+3H+=HS-+H2S
考点:考查化学平衡状态的判断及计算,盖斯定律的应用,混合溶液的离子判断及计算


科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:简答题
(15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
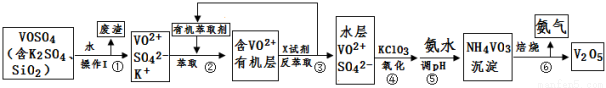
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
已知X,Y声是元素周期表中前20号元素:|x-y|=3, X, Y能形成化合物M,下列说法正
确的是
A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径
B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性
C.若M属于共价化合物,则该分子中原子个数比可能为1:2
D.若M属于离子化合物,则该化合物中只存在离子键
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各组材料中,不能组成原电池的是( )
| A | B | C | D |
两极材料 | 锌片、石墨 | 铜片、银片 | 锌片、铜片 | 铁片、铜片 |
插入溶液 | 稀硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
下列比较或归纳正确的是
A.稳定性:NH3<PH3<ASH3
B.离子半径:Cl->S2->Al3+
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:Be(OH)2>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:选择题
苯环上有两个侧链烃基的有机物C12H18,其同分异构体的数目为(不考虑立体异构)
A.39 B.42 C.45 D.48
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:填空题
(8分)有一瓶澄清的溶液,其中可能含有NH4+、K+、 Ba2+、Al3+、Fe3+、 I-、NO3-、CO32-、SO42-、AlO2- 。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除 离子的存在。
(2)由②可以证明 离子的存在,同时排除 离子存在。理由是_________________________。
(3)由③可证明 离子存在。
(4)由④可以排除 离子存在,同时证明 离子的存在。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
下列表述不正确的是( )
A.131I与127I互为同位素,化学性质几乎相同
B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素
C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶
D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省绍兴市柯桥区高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(15分)浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样中的COD。主要的实验装置、仪器及具体操作步骤如下:
实验装置及仪器:

操作步骤:
①用仪器c将20.00mL水样置于250mL锥形瓶中,加入数粒碎瓷片。
②在水样中加入重铬酸钾标准溶液10.00mL,安装回流装置(如上图所示),从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应。
③冷却后加指示剂2d,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。
已知:Cr2O72—+14H++6Fe2+=6Fe3++2Cr3++7H2O
请你回答下列问题:
(1)仪器c的名称: ;用仪器c吸取液体时,左手拿洗耳球,右手将仪器c插入溶液中吸取,当 时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹液面最低处与标线相切,立即按紧管口。
(2)下列有关操作不正确的是 (用相应编号填写)
A.用硫酸亚铁铵溶液滴定时需上述仪器中的仪器b
B. 仪器c在使用时需要先用待取液进行润洗,管尖残留的液体一般不要吹出
C.加入数粒碎瓷片的作用是可以防止液体暴沸
D.上述操作步骤③中在滴定时判断滴定终点的指示剂可以是甲基橙
E.加热回流结束后,要用蒸馏水对冷凝管管壁进行冲洗
(3)在加热回流过程中,可以用水浴作为恒温加热源吗?同时请说明理由。
(4)下列因素对测定水样中的COD能产生影响的有 (用相应编号填写)
①硫酸的用量 ②反应装置中的锥形瓶在反应前用蒸馏水洗涤
③重铬酸钾的用量 ④回流时间的长短
(5)实验室配制重铬酸钾标准溶液的主要步骤及装置如下所示:

将上述实验步骤A到F按实验过程先后次序排列
(6)已知:重铬酸钾标准溶液的c(Cr2O72—)=0.0250mol·L—1,硫酸亚铁铵溶液的c(Fe2+)=0.0100 mol·L—1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为12.00mL,则按上述实验方法,测得的该水样的化学需氧量CODCr(O2)= mg/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com