
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约___mol·L-1(小数点后保留一位)。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。需要称量NaClO固体的质量为__g。下列为打乱了的操作示意图,其正确排序为____。

(4)配制过程中下列各项操作对消毒液物质的量浓度有和影响(填“偏小”、“偏大”或“无影响”)
A.用托盘天平称量NaClO固体时,砝码生锈___。
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水____。
C.定容时,俯视容量瓶刻度线进行定容____。
【答案】4.0 0.04 149 ③④①⑥②⑤ 偏大 无影响 偏大
【解析】
(1)依据![]() 计算该“84消毒液”的物质的量浓度;
计算该“84消毒液”的物质的量浓度;
(2)根据稀释前后溶质物质的量不变进行计算;
(3)配制480mL含NaClO的消毒液,应用500mL容量瓶,实际上配制的是500mLNaClO溶液,再依据公式n=cV,m=nM计算NaClO的质量;依据配制一定物质的量浓度溶液的一般步骤排序;
(4)依据配制一定物质的量浓度溶液的正确操作步骤判断,根据![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)该“84消毒液”的物质的量浓度约为![]()
故答案为:4.0;
(2)已知该“84消毒液”通常稀释100倍(体积之比)后使用,由(1)知该“84消毒液”的浓度约为4.0mol/L,稀释前后钠离子物质的量不变,则c(Na+)原V= c(Na+)稀释×100V,则稀释后的溶液中c(Na+)稀释=0.04mol·L-1;
故答案为:0.04;
(3)配制480mL含NaClO质量分数为25%的消毒液,应用500mL容量瓶,实际上配制的是500mLNaClO溶液,则NaClO的物质的量为n=cV=0.5L×4.0mol/L=2mol,质量m=nM=2mol×74.5g/mol=149g;配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以正确的操作排序为:③④①⑥②⑤;
故答案为:149;③④①⑥②⑤;
(4)A.用托盘天平称量NaClO固体时,砝码生锈,称得的NaClO质量偏大,则溶液浓度偏大;
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,无影响;
C.定容时,俯视容量瓶刻度线进行定容,导致溶液体积偏小,配制溶液的浓度偏大;
故答案为:偏大;无影响;偏大。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 植物油和溴水混合后振荡、静置 | 溶液分层,溴水褪色 | 植物油萃取了溴水中的Br2 |
B | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液中 | 溶液变黄色 | H2O2的氧化性比Fe3+弱 |
C |
| 出现白色沉淀 | 氨气、二氧化碳与饱和食盐水反映生成碳酸钠 |
D | 将盛有铜与浓硫酸的试管加热,发现试管底部出现白色固体,倒去试管中液体,再加入适量水 | 白色固体溶解,溶液显蓝色 | 白色固体为无水硫酸铜 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
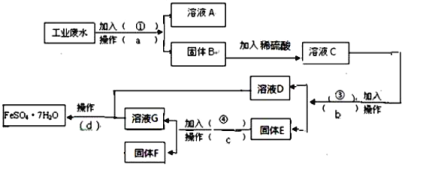
(1)操作a的名称为___,所需要的玻璃仪器除烧杯外还需要___。
(2)固体E的成分为___,加入试剂④时发生的化学方程式为___。
(3)加入试剂①的目的是___。
(4)从溶液D和溶液G中得到FeSO4·7H2O晶体的操作为蒸发浓缩、___、___、洗涤、干燥。
(5)若废水中硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液,其中c(Cu2+)=0.1mol/L,c(Fe2+)=0.4mol/L,c(SO42-)=0.6 mol/L,已知氢离子浓度忽略不计,则c(Na+)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
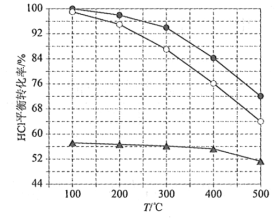
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
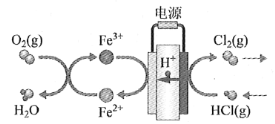
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请按要求填空:
(1)2molO2和__gCH4在标准状况下占有相同的体积,其体积为___L。
(2)标况下,现有96g的氧气和44.8升的二氧化碳两者的密度之比为___;两者的体积之比为___。
(3)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为___。
(4)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为___。
(5)在某温度下,NaOH的溶解度为20g,该温度下将80gNaOH投入220g水中,充分搅拌后,测得溶液的密度为1.2g/mL,则该溶液中溶质的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(4)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,且离子具有相同的电子层结构。X的一种单质可杀菌消毒。W原子的最外层电子数与最内层电子数相等。下列说法不正确的是
A. 原子半径r(Z)>r(W)>r(X)>r(Y)
B. X的简单氢化物热稳定性比Y的强
C. 四种元素常见单质中,Y2的氧化性最强
D. X能与Z形成Z2X2,该化合物中含离子健和非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com