
| A. | pH=12 | |
| B. | pH=2 | |
| C. | 由水电离产生的[H+]=1.0×10-2mol•L-1 | |
| D. | 溶质的物质的量浓度为0.01 mol•L-1 |
分析 100mL 0.02mol•L-1的Ba(OH)2溶液中氢氧根离子浓度物质的量为:0.02mol•L-1×0.1L×2=0.004mol;100mL 0.02mol•L-1的NaHSO4溶液中氢离子的物质的量为:0.02mol•L-1×0.1L=0.002mol,两溶液混合后氢氧根离子过量,溶液显示碱性,根据氢氧根离子、氢离子的物质的量计算出混合后溶液中氢氧根离子的浓度,再计算出溶液的pH;氢氧化钡与硫酸氢钠等物质的量反应,反应后溶质为氢氧化钠,根据钠离子守恒计算出氢氧化钠的物质的量及浓度,据此进行解答.
解答 解:100mL 0.02mol•L-1的Ba(OH)2溶液中氢氧化钡物质的量为:0.02mol•L-1×0.1L=0.002mol,氢氧根的物质的量为0.004mol;
100mL 0.02mol•L-1的NaHSO4溶液中硫酸氢钠的物质的量为:0.02mol•L-1×0.1L=0.002mol,氢离子的物质的量为:0.002mol;
A.两溶液混合后,氢氧根离子过量,溶液显示碱性,反应后的溶液中氢氧根离子浓度为:$\frac{0.004mol-0.002mol}{0.1L+0.1L}$=0.01mol/L,溶液的pH=12,故A正确;
B.根据A的计算结果可知,反应后的溶液的pH=12,故B错误;
C.碱溶液中氢离子是水电离的,水电离的氢离子浓度为为1.0×10-12 mol•L-1,故C错误;
D.等物质的量浓度氢氧化钡与硫酸氢钠反应生成水、硫酸钡沉淀和氢氧化钠,反应后的溶质为氢氧化钠,根据钠离子守恒,氢氧化钠的物质的量为0.02mol,氢氧化钠的浓度为0.01mol/L,故D正确;
故选AD.
点评 本题考查了酸碱混合后的定性判断及溶液的pH的计算,题目难度中等,注意掌握酸碱反应后溶液定性判断方法及溶液的pH的计算方法,选项D混合后溶液的体积增大了一倍,生成的氢氧化钠的浓度减小一半,为易错点.


科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
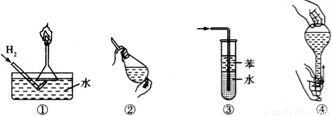
A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸(氨气或氯化氢均极易溶于水)
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4ab}{cNA}$ L | B. | $\frac{22.4b}{acNA}$ L | C. | $\frac{22.4ac}{bNA}$ L | D. | $\frac{22.4bc}{aNA}$ L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时,pH=2的醋酸.请回答以下问题:
醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时,pH=2的醋酸.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6:9:8 | B. | 2:3:6 | C. | 1:3:4 | D. | 3:8:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com