
【题目】T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示,已知:物质A、B、C均为气态,D为固态,正反应时吸热反应,根据要求回答下列问题: 
(1)容器中反应的化学方程式为
(2)前2 min,v(A)=mol(minL)﹣1 .
(3)能说明该反应已达到平衡状态的是 .
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T℃时,该反应的平衡常数K=(保留小数点后两位).
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母).
A.只增加A的物质的量
B.移走一部分D
C.升高反应体系的温度
D.把容器的体积缩小一倍
(6)T℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)v(逆)(填“>”“<”或“=”).
【答案】
(1)2A+B?3C+D
(2)0.4
(3)D
(4)1.69
(5)C
(6)<
【解析】解:(1)A、B的物质的量减少,为反应物;C、D的物质的量增加,为生成物,达到平衡时,△n(A)=0.8mol﹣0.4mol=0.4mol,△n(B)=1mol﹣0.0mol=0.2mol,△n(C)=0.6mol,△n(D)=0.2mol,则A、B、C、D的化学计量数之比为0.4:0.2:0.6:0.2=2:1:3:1,故反应的化学方程式为:2A+B3C+D,
故答案为:2A+B3C+D;(2)前2 min,n(A)=0.8mol﹣0.4mol=0.4mol,则v(A)= ![]() =0.4mol(minL)﹣1,
=0.4mol(minL)﹣1,
故答案为:0.2;(3)A.反应前后混合气体物质的量不变,恒温恒容下,混合气体的压强始终不变,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体的密度为定值,故B错误;
C.消耗0.1mol的B同时生成0.1mol的D,均表示正反应速率,反应始终按该比例关系进行,故C错误,
D.可逆反应得到平衡时,各组分的物质的量不变,B的物质的量不变说明反应到达平衡,故D正确,
故选:D;(4)平衡时A为0.4mol、B为0.8mol、C为0.6mol,反应前后气体的物质的量不变,可以用物质的量代替浓度计算平衡常数,则K= ![]() =
= ![]() =1.69,
=1.69,
故答案为:1.69;(5)A.只增加A的物质的量,平衡虽然正向移动,但A的转化率减小,故A错误;
B.D为固体,移走一部分D,不影响平衡移动,故B错误;
C.正反应为吸热反应,升高反应体系的温度,平衡正向移动,A的转化率增大,故C正确;
D.把容器的体积缩小一倍,压强增大,反应前后气体体积不变,平衡不移动,故D错误,
故选:C;(6)此时浓度商Qc= ![]() =7.8>K=1.69,故反应向逆反应进行,则v(正)<v(逆),
=7.8>K=1.69,故反应向逆反应进行,则v(正)<v(逆),
故答案为:<.
(1)A、B的物质的量减少,为反应物;C、D的物质的量增加,为生成物,达到平衡时A、B、C、D改变的物质的量分别为0.4mol、0.2mol、0.6mol、0.2mol,则A、B、C、D的化学计量数之比0.4:0.2:0.6:0.2=2:1:3:1,故反应的化学方程式为:2A+B3C+D;(2)根据v= ![]() 计算v(A);(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;(4)反应前后气体的物质的量不变,用物质的量代替浓度代入K=
计算v(A);(3)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;(4)反应前后气体的物质的量不变,用物质的量代替浓度代入K= ![]() 计算平衡常数;(5)正反应为气体体积不变的吸热反应,改变条件使A的转化率增大,应使平衡正向移动,但不能只增大A的浓度,D为固体,D的物质的量变化不影响平衡移动,可以是升高温度、移走C、或增大B的浓度;(6)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
计算平衡常数;(5)正反应为气体体积不变的吸热反应,改变条件使A的转化率增大,应使平衡正向移动,但不能只增大A的浓度,D为固体,D的物质的量变化不影响平衡移动,可以是升高温度、移走C、或增大B的浓度;(6)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.


科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5和PM10都是空气质量指数(AQI)的重要指标
B. 汽车尾气中的NO2和CO2都是大气污染
C. 聚乙烯和聚氯乙烯随意乱扔都能产生白色污染
D. 含N和P的大量污水任意排放都能导致水体富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( ) 
A.a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42﹣移向甲烧杯
D.b电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气制备有机中间体B和高分子I的一种合成路线如下(部分反应条件已略去):
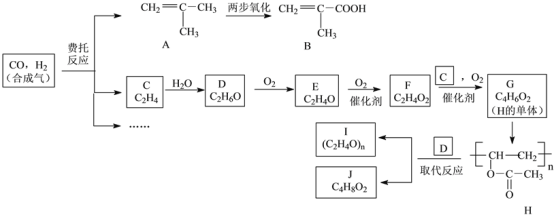
(1)B中所含官能团名称是____和____。
(2)G生成H的反应类型是____。
(3)D生成E的化学方程式为____;实验室由D和F制备J的化学方程式为____。
(4)G的结构简式为____;I的结构简式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
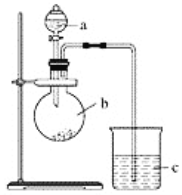
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
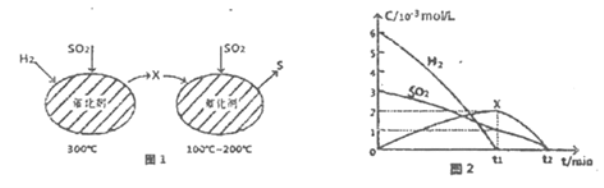
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三张蓝色石蕊试纸用蒸馏水润湿后贴在玻璃片上,然后按顺序分别滴加足量的浓硝酸、浓硫酸和浓盐酸,三张纸最终变成( )
A.白色、红色、红色
B.红色、红色、红色
C.红色、黑色、白色
D.白色、黑色、红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com