
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
分析 A.一水合氨在离子反应中保留化学式;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.反应生成硝酸铜、NO和水;
D.反应生成碳酸氢钙、HClO.
解答 解:A.向盐酸中滴加氨水的离子反应为H++NH3.H2O═H2O+NH4+,故A错误;
B.Fe(OH)3溶于氢碘酸的离子反应为2Fe(OH)3+2I-+6H+═2Fe2++I2+6H2O,故B错误;
C.铜溶于稀硝酸的离子反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.向次氯酸钙溶液中通入过量CO2的离子反应为ClO-+H2O+CO2═HCO3-+HClO,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 维生素C是有机物 | |
| B. | 一个维生素C分子中含有20个原子 | |
| C. | 一个维生素C分子由碳、氢、氧三种元素组成 | |
| D. | 某些蔬菜、水果中富含维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 |
| 图示 |  |  |
| 选项 | C | D |
| 研究目的 | 平衡体系中增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质(杂质) | 试剂 | 有关离子方程式 |
| NaHCO3(Na2CO3) | ||
| FeCl2(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
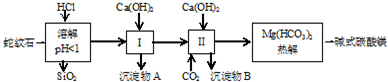
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下甲和乙的密度之比为1:1 | |
| B. | 等质量的甲和乙中的原子数之比为1:1 | |
| C. | 同温同体积下等质量的甲和乙的压强之比为1:1 | |
| D. | 甲与乙的相对分子质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
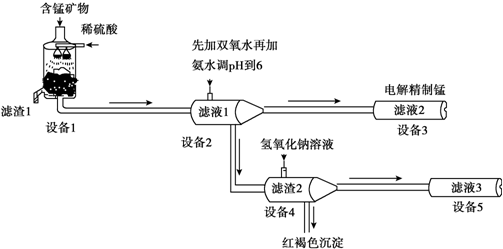
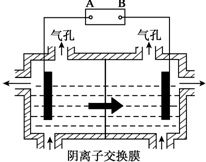 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com