
ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣��֪��
CO(g)+H2O(g) H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
|
�¶�/�� |
400 |
500 |
800 |
|
ƽ�ⳣ��K |
9.94 |
9 |
1 |
�Իش���������
��1����������Ӧ�� ��Ӧ ������ȡ������ȡ���
��2��Ҫʹ������Ӧ���淴Ӧ����������ƽ������Ӧ�����ƶ������д�ʩ�����е���
A��������� B������CO�����ʵ����������ϵ��ѹǿ
C�������¶� D����СH2��Ũ��
��3����ij�ܱ������г���2molCO��4molH2O(g)��������Ӧ��CO(g)+H2O(g) H2(g)+CO2(g)������Ӧ��ƽ��ʱ��CO���������ΪX����ά��������������¶Ȳ��䣬��ʼ���ʰ�����������ȳ���������У��ﵽƽ��ʱCO���������������X����
H2(g)+CO2(g)������Ӧ��ƽ��ʱ��CO���������ΪX����ά��������������¶Ȳ��䣬��ʼ���ʰ�����������ȳ���������У��ﵽƽ��ʱCO���������������X����
A��1molCO(g)+4molH2O+2molCO2(g)+2molH2(g) B��2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C��1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g) D��1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
��4������Ӧ��800��ʱ���У�����ʼCO��H2O(g)��Ϊ5mol��ˮ�������������ΪX��ƽ��ʱCO��ת����Ϊy����y��x�仯�ĺ�����ϵʽΪy=
��5����VL�ܱ�������ͨ��10mol CO��10molˮ��������T��ﵽƽ�⣬Ȼ����ͨ����ʯ�ң������û������ȼ�գ���÷ų�������Ϊ2845KJ����֪COȼ����Ϊ283KJ/mol��H2ȼ����Ϊ286KJ/mol������T��ƽ�ⳣ��K= ��T= K��0��ʱT=273K��
��10�֣���ÿ��2�֣���1�����ȣ�2��ACD��3��BC��4��x��5��1 1073
��������
�����������1���ɱ���֪���¶�Խ�ߣ�ƽ�ⳣ��ԽС����Ӧ���г̶�ԽС��ƽ�����淴Ӧ�ƶ��������¶�ƽ�������ȷ����ƶ���������ӦΪ���ȷ�Ӧ����2��A.�������ֻ�ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬����B.����CO�����ʵ����������ϵ��ѹǿ��CO��g��+H2O��g��⇌H2��g��+CO2��g����Ӧ���������ʵ�������ķ�Ӧ������һ����̼���ʵ���ƽ��������У��������������ʵ�������ѹǿ������ȷ��C.��Ӧ�Ƿ��ȷ�Ӧ�����£����ʼ�Сƽ��������У�����D.��С����Ũ�ȣ�ƽ��������У������ʼ�С������3����ij�ܱ������г���2molCO��4molH2O��g����CO��g��+H2O��g��⇌H2��g��+CO2��g��������Ӧ��ƽ��ʱ��CO���������ΪX��A.���ü���������1molCO��g��+4molH2O+2molCO2��g��+2molH2��g�������練Ӧ��ȫת��ΪCO��H2O���ʵ���Ϊ��3mol��6mol=1��2����Ӧǰ������������䣬ƽ����ͬ��CO���������Ϊx�������ϣ�B.���ü���������2molCO��g��+2molH2O+2molCO2��g��+2molH2��g�������練Ӧ��ȫת��ΪCO��H2O���ʵ���Ϊ��3mol��3mol=1��1����Ӧǰ������������䣬ƽ��������У�CO�������������x�����ϣ�C.���ü���������1molCO��g��+3molH2O+0.8molCO2��g��+0.8molH2��g�������練Ӧ��ȫת��ΪCO��H2O���ʵ���Ϊ��1.8mol��3.8mol=9��19����Ӧǰ������������䣬ƽ��������У�CO���������С��x�����ϣ�D.���ü���������1molCO��g��+3molH2O+1molCO2��g��+1molH2��g�������練Ӧ��ȫת��ΪCO��H2O���ʵ���Ϊ2mol��4mol=1��2������Ӧ�ﵽƽ��ʱ��CO���������Ϊx�������ϣ�
��4����800��ʱ��Ӧƽ�ⳣ��Ϊ1��
CO��g��+ H2O��g��⇌ H2��g��+ CO2��g����
��ʼ��5��1-x�� 5x 0 0
ת����5��1-x��y 5��1-x��y 5��1-x��y 5��1-x��y
ƽ�⣺5��1-x����1-y��5��x-y+xy�� 5��1-x��y 5��1-x��y
����ƽ�ⳣ��k=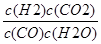 =
=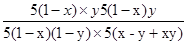 =1�����y=x����5���ɷ���ʽCO��g��+H2O��g��⇌H2��g��+CO2��g����֪����1molCO��Ӧ������1molH2����ʼͨ��10molCO������ƽ��ʱ��CO��H2�����ʵ�����Ϊ10mol����ƽ��ȼ����Ϊ=284.5kJ/mol������ƽ��ֵ������CO��H2�����ʵ���֮�ȣ���CO��H2���ʵ���Ϊx��y��x+y=10
283x+286y=2845 ����õ�x=y=5mol��
=1�����y=x����5���ɷ���ʽCO��g��+H2O��g��⇌H2��g��+CO2��g����֪����1molCO��Ӧ������1molH2����ʼͨ��10molCO������ƽ��ʱ��CO��H2�����ʵ�����Ϊ10mol����ƽ��ȼ����Ϊ=284.5kJ/mol������ƽ��ֵ������CO��H2�����ʵ���֮�ȣ���CO��H2���ʵ���Ϊx��y��x+y=10
283x+286y=2845 ����õ�x=y=5mol��
��������ʽ�����ƽ��ʱ����ֵ����ʵ�����
CO��g��+H2O��g��⇌H2��g��+CO2��g����
��ʼ��10mol 10mol 0 0
ת����5mol 5 mol 5mol 5mol
ƽ�⣺5mol 5mol 5mol 5mol
���Գ���ƽ�ⳣ��ΪK=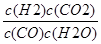 =1��ͼ��������֪�¶�Ϊ800��C��T=273+800=1073K.
=1��ͼ��������֪�¶�Ϊ800��C��T=273+800=1073K.
���㣺��ѧƽ�ⳣ���ĺ��壻��ѧƽ���Ӱ�����أ���Чƽ�⣻��ѧƽ��ļ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| [H2]?[CO2] |
| [CO]?[H2O] |
| [H2]?[CO2] |
| [CO]?[H2O] |
| A | B | C | D | |
| n��CO2�� | 3 | 1 | 0 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 |
| n��CO�� | 1 | 2 | 3 | 0.5 |
| n��H2O�� | 5 | 2 | 3 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 427 | 700 | 800 |
| ƽ�ⳣ�� | 9.94 | 9 | b | 0.64 |
| ��Ӧʱ��/min | n��CO��/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n��CO2��/mol | 3 | 1 | 0 | 1 |
| n��H2��/mol | 2 | 1 | 0 | 1 |
| n��CO��/mol | 1 | 2 | 3 | 0.5 |
| n��H2O��/mol | 5 | 2 | 3 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����
H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n��CO2�� | 3 | 1 | 0 | 1 | 1 |
| n��H2�� | 2 | 1 | 0 | 1 | 2 |
| n��CO�� | 1 | 2 | 3 | 0.5 | 3 |
| n��H2O�� | 5 | 2 | 3 | 2 | 1 |
 2CO��g��ƽ�ⳣ��K��
2CO��g��ƽ�ⳣ��K�� CO��g��+H2��g�� ƽ�ⳣ��K1��
CO��g��+H2��g�� ƽ�ⳣ��K1�� H2��g��+CO2��g�� ƽ�ⳣ��K2��
H2��g��+CO2��g�� ƽ�ⳣ��K2��| K1 |
| K2 |
| K1 |
| K2 |
| 4 |
| 9 |
| 4 |
| 9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������CH3COOH��l��+C2H5OH��l��
��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������CH3COOH��l��+C2H5OH��l��| ŨH2SO4 |
| �� |
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
| n��CO�� | n��H2O�� | n��H2�� | n��CO2�� | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com