

分析 I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,则E为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3.
解答 解:I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,则E为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3.
(1)由上述分析可知,F为Al2O3,G为FeCl2,故答案为:Al2O3,FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离,故答案为:利用磁铁吸出铁;
(3)D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水(或碳酸钠、碳酸氢钠、偏铝酸钠)等,故选:C;
(4)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
H→I为氢氧化亚铁被氧化为氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象是:产生的白色沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;4Fe(OH)2+O2+2H2O=4Fe(OH)3,产生的白色沉淀迅速变成灰绿色,最后变成红褐色;
(5)检验FeCl2溶液中的阳离子的方法:取少G溶液于试管中,向试管中滴入几滴KSCN溶液无现象,向的混合溶液中再加入氯水,溶液变成红色,
故答案为:取少G溶液于试管中,向试管中滴入几滴KSCN溶液无现象,向的混合溶液中再加入氯水,溶液变成红色.
点评 本题以“无机框图题”的形式考查无机物推断、元素单质及其化合物的性质,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,I的颜色及金属A能与盐酸、氢氧化钠溶液反应是推断突破口.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 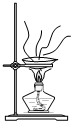 用装置蒸发、结晶制取粗盐 | B. | 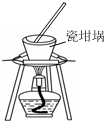 用装置加热熔融NaOH固体 | ||
| C. | 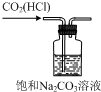 用装置除去CO2中的少量HCl | D. | 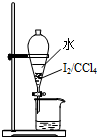 用装置进行萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.09mol | B. | 0.1 mol | C. | 0.2 mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
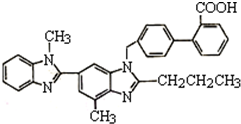 替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )
替米沙坦片是治疗原发性高血压的一种白色药片,其主要成份为替米沙坦,化学结构如图所示.下列关于替米沙坦的说法中错误的是( )| A. | 该物质属于芳香族化合物 | |
| B. | 能发生加成反应、取代反应和酯化反应 | |
| C. | 替米沙坦的分子式为C32H28O2N4 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
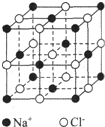
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验NH4+时,加浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝,则可证明原溶液中含有NH4+ | |
| B. | 检验SO42-时,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,则可证明含SO42- | |
| C. | 用天平和小烧杯称量5.40gNaOH固体 | |
| D. | 用饱和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈红褐色即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
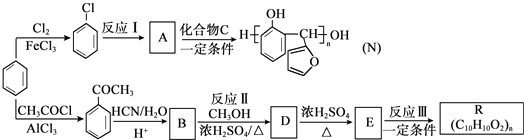

 .
. 生成
生成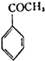 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂.
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用催化剂和吸水剂. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
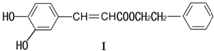
| A. | 遇FeCl3溶液可能显紫色 | |
| B. | 可发生酯化反应和银镜反应 | |
| C. | 能与溴发生取代和加成反应 | |
| D. | 1mol化合物I最多能与2molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com